Il presente articolo ha lo scopo di presentare il processo di liofilizzazione a coloro che utilizzeranno questo procedimento in futuro o che attualmente stanno usando un liofilizzatore e desiderano sapere di più sul suo funzionamento.
-
Introduzione
Scopo del fascicolo: Destinatari
Struttura del fascicolo: Introduzione in due parti e supplementi
-
Descrizione di alcuni termini
Definizioni di sinonimi
- essicazione – disidratazione
- prodotto – campione – materiale – solidi
- acqua – umidità – solvente
- freeze drying – liofilizzazione
Definizione di soluzione
- soluzione-solidi/soluto-solvente
Nota sul glossario
Cos’è l’essiccazione?
Perché essiccare un campione?
In che modo possiamo essiccare il nostro prodotto?
-
Cos’è la liofilizzazione e perché scegliere questo processo?
Un’analisi iniziale
Com’è una tipica liofilizzazione?
Uno sguardo più approfondito alle proprietà dei materiali
Introduzione al trasferimento di calore e di materia
-
Uno sguardo più approfondito al processo di liofilizzazione
Congelamento, velocità di congelamento e sublimazione del trasporto di materia, interfaccia e mantenimento del desorbimento della struttura, gradienti di umidità, end-point
-
Domande da porsi nella scelta o nell’uso di un liofilizzatore
Proprietà del materiale
- requisiti di congelamento: concentrazione, compensazione, temperatura
- comportamento di stabilità: temperatura, limiti, contenuto di umidità finale
Capacità necessarie
- volume del lotto, caricamento nella camera
- velocità di produzione
Parametri di liofilizzazione
- temperature di riscaldamento
- tipi di camera, superficie campione, aree nei contenitori
-
Supplementi
-
Riferimenti generali sulla liofilizzazione
- Introduzione
- Descrizione di alcuni termini
- Cos’è l’essiccazione?
- Perché essiccare un campione?
- Preparazione dei campioni di tessuto adatti per l’analisi istologica che impiegano tecniche di microscopio, inclusa la microscopia elettronica.
- Preparazione del campione come fase primaria delle procedure di analisi chimiche/biochimiche.
- Stabilità di conservazione dei materiali a lungo termine, come ad esempio cibi, cellule microbiche, enzimi per kit di analisi, sangue, ecc.
- Recupero di prodotti da una miscela di reazione in una forma (essiccata) facilmente maneggiabile.
- Microorganismi (batteri, lieviti), comprese le colture starter nella carne e nei latticini
- Virus
- Vaccini e frazioni ematiche antitossine
- Enzimi (per sistemi analitici e/o reazioni in generale)
- Tessuti e materiali ossei per trapianti
- Reagenti e standard biologici
- Materie alimentari (bevande, frutta, verdura, carne, pesce)
- Animali interi per esposizione in musei
- Oggetti archeologici (legno, pelle, carta)
- Preparati farmaceutici
- Vitamine
- La maggior parte degli agenti sensibili nei laboratori chimici / biochimici (compresi i radicali liberi e i mezzi fisiologici)
- Tessuti e cellule per microscopia elettronica
- In che modo possiamo essiccare il nostro prodotto?
- Liofilizzazione (I, L)
- Essiccazione in camera (I, L)
- Essiccazione a tunnel (I)
- Essiccazione spray (I, L)
- Essiccazione istantanea (I)
- Essiccazione a letto fluido (I)
- Essiccazione a tamburo (I)
- Essiccazione su nastro (I)
- Essiccazione a punto critico (L)
- Essiccazione a vuoto (I, L)
- Essiccazione a microonde (I)
- Essiccazione a macro-onde (I)
- Cos’è la liofilizzazione e perché scegliere questo processo?
- il materiale viene solidificato prima dell’essiccazione
- la rimozione della maggior parte dell’acqua dal campione avviene tramite una conversione diretta dell’acqua dalla stato solido a quello gassoso.
- Cos’è un liofilizzatore tipico?
- Pompa da vuoto
- Condensatore refrigerato
- Dispositivi di controllo e di misurazione
- Camere del campione
- Sistemi di tubi e valvole
- Sistemi di tubi e valvole
- Controller per la registrazione della temperatura / vuoto
- Uno sguardo più approfondito alle proprietà del materiale
- Imbrunimento non-enzimatico (compresa la reazione di Maillard e la disidratazione a catalizzatore acido)
- Denaturazione proteica
- Distruzione del nutriente
- Ossidazione lipidica
- Rotture dell'acido nucleico
- Introduzione al trasferimento di calore e di materia
- Uno sguardo più approfondito al processo di liofilizzazione
-
È possibile abbassare la temperatura del condensatore (per es da -50°C a -80°C). Questo provoca un abbassamento della pressione dell’acqua nel condensatore. Ciò porta il valore della pressione dell’acqua a zero (ovvero si arresta il trasferimento della materia) ad un valore minore dell’acqua nel campione, che corrisponde ad un minore contenuto di umidità nel campione. Poiché, in realtà, è la riduzione della forza motrice (gradiente della pressione) che limita il livello di umidità finale, questo metodo ha un’efficacia ridotta per la maggior parte dei materiali normali.
Un moderno liofilizzatore da laboratorio è dotato di un condensatore refrigerato che funziona a circa -50°C (p = 0,04 mbar). L’ulteriore diminuzione di pressione raggiunta tramite un funzionamento del condensatore a temperature molto basse (per esempio -80°C; p = 0,0005 mbar) è piuttosto ridotta, se messa a confronto con la pressione di saturazione dell’acqua che si verifica alla temperatura del campione (0,023 mbar per +20°C). Mentre l’ulteriore diminuzione della pressione extra nel condensatore sembrerebbe consentire una pressione finale minore nel campione, questa non ha quasi alcun effetto rispetto all’aumento del gradiente della pressione e quindi all’attuale perdita d’acqua.
Dobbiamo concludere che temperature estremamente basse del condensatore sono necessarie solo in casi speciali in cui il materiale da liofilizzare possiede una stabilità strutturale molto ridotta ed è pertanto in grado di tollerare solo temperature basse. In questo caso, la pressione dell’acqua del campione stesso è bassa ed il cambiamento della pressione del condensatore ha un effetto significativo sull’intero gradiente.
-
Il secondo metodo, l’aumento della temperatura del campione, promette di più poiché l’aumento della pressione dell’acqua nel campione è piuttosto dimensionabile. Per una data pressione dell’acqua nel condensatore (ovvero una data temperatura nel condensatore), l’aumento della temperatura del campione provoca un aumento significativo del gradiente della pressione e, allo stesso tempo, le pressioni del campione e del condensatore si bilanciano con un contenuto molto inferiore di umidità nel campione. Un aumento della temperatura del campione da +20°C a +30°C provoca un aumento della saturazione della pressione da 23,3 mbar a 42,3 mbar, corrispondente a quasi il doppio del gradiente.
Le considerazioni sulla stabilità strutturale e chimica impongono dei limiti alle temperature a cui è possibile portare i campioni. È interessante notare tuttavia che la stabilità generalmente dipende sia dalla temperatura sia dal contenuto di umidità e pertanto la stabilità potenzialmente diminuita a causa di un aumento di temperatura potrebbe in qualche modo essere bilanciata incrementando la stabilità associata con la riduzione del contenuto di umidità; alla fine, tuttavia, vi sono dei limiti ai possibili aumenti della temperatura.
Inoltre, come nelle due fasi di liofilizzazione, anche nella fase di desorbimento è necessario fornire energia per formare il vapore acqueo dalle molecole legate dell’acqua. Poiché le resistenze al trasferimento di calore dovute al materiale essiccato sono elevate, per ottenere la necessaria trasmissione di energia sono necessari dei gradienti di temperatura nel campione. La variazione di temperatura nel campione indica una distribuzione di contenuti di umidità nello strato essiccato. Cfr. Figura 11.
È essenziale che al termine del processo di liofilizzazione tutti i punti del campione abbiano dei contenuti di umidità inferiori al livello richiesto per la stabilità del prodotto. Il contenuto medio di umidità per il campione non deve pertanto trovarsi al di sotto del livello necessario per la stabilità.
Ciò significa che dopo che anche l’ultimo cristallo di ghiaccio è sparito e la fase di sublimazione terminata, si dovrà attendere un tempo sufficiente per consentire a tutti i punti del campione di desorbire l’acqua legata residua. L’ultima regione da desorbire al livello desiderato sarà quella adiacente agli ultimi cristalli di ghiaccio che stanno svanendo.
A causa della lentezza del trasferimento di calore (dovuta alle elevate resistenze di trasferimento di calore) e alla ridotta differenza di pressione dell’acqua (dovuta alla diminuzione della pressione dell’acqua nel campione con il procedere dell’essiccazione), il desorbimento risulta generalmente lento, specialmente considerando la quantità d’acqua relativamente piccola da eliminare (generalmente 1-10 % della quantità totale dell’acqua presente originariamente). Così, tutti i fattori in grado di accelerare il desorbimento, come ad esempio l’aumento della temperatura del campione, hanno un’influenza significativa sulla riduzione del tempo totale del processo.
- Domande da porsi al momento della scelta o dell’uso di un liofilizzatore
- Supplementi
- Riferimenti generali sulla liofilizzazione
Il presente articolo ha lo scopo di presentare il processo di liofilizzazione a coloro che utilizzeranno questo procedimento in futuro o che attualmente stanno usando un liofilizzatore e desiderano sapere di più sul suo funzionamento.
Per venire incontro a lettori con esigenze diverse, il fascicolo è stato diviso in due parti.
La prima parte, che comprende il testo principale, fornisce una breve e concisa analisi dei vari aspetti della liofilizzazione relativamente al processo e ai materiali da liofilizzare.
Nella seconda parte si trovano supplementi agli argomenti trattati nel testo principale, nei quali sono contenute spiegazioni complete dei fenomeni coinvolti nel processo di liofilizzazione.
Consigliamo una prima lettura completa del testo principale, al fine di ottenere una visione generale, per poi dedicarsi successivamente all’esame dei supplementi di interesse.
Prima di iniziare il testo principale, è bene definire alcuni termini.
I termini essiccazione e disidratazione sono utilizzati in maniera intercambiabile per descrivere il processo della completa eliminazione dell’acqua da un materiale.
I termini prodotto, campione e materiale sono usati in maniera intercambiabile per descrivere le “cose” che verranno liofilizzate o le “cose” che si ottengono successivamente al processo di liofilizzazione.
I termini acqua e umidità sono utilizzati in maniera intercambiabile per descrivere ciò che deve essere eliminato dal campione tramite liofilizzazione.
I termini freeze drying e liofilizzazione possono essere usati in maniera intercambiabile per descrivere, appunto, la liofilizzazione stessa.
Infine, è bene definire tre termini che fanno riferimento al nostro campione, ossia: solidi o soluto e solvente.
Solvente è il materiale liquido in cui si trovano i solidi o i soluti. In questo fascicolo, l’acqua è il solvente.
I solidi possono essere suddivisi in due gruppi: quelli solubili (presenti nel solvente come singole molecole) e quelli insolubili (presenti nel solvente come gruppi di molecole). I solidi solubili e i solventi costituiscono una soluzione, mentre i solidi insolubili e i solventi costituiscono una sospensione. Un campione può contenere nel solvente sia solidi solubili sia insolubili.
L’essiccazione o disidratazione è un processo in cui il solvente presente nel campione – nel nostro caso l’acqua – viene fisicamente estratto in modo da ottenere solidi in condizioni essenzialmente secche (es. privi d’acqua).
Sono molte le ragioni per cui si desidera essiccare un materiale, come elencato qui di seguito. È necessario ricordare che l’obiettivo principale di un processo di liofilizzazione è ottenere un materiale essiccato che rispecchi uno o più obiettivi di quelli elencati nella Tabella 1, essendo quindi il prodotto finale l’aspetto più importante della liofilizzazione.
Tabella 1: Obiettivi di liofilizzazione legati al prodotto
|
|
Per analizzare questi obiettivi della liofilizzazione possiamo impiegare, come esempi, alcuni dei materiali elencati nella Tabella 2 per i quali la liofilizzazione risulta auspicabile.
Dall’ampia varietà di prodotti in questo elenco si evidenzia che le differenze degli obiettivi specifici da raggiungere con la liofilizzazione di un prodotto e quelle delle sue proprietà danno luogo ad esigenze estremamente varie nel processo di liofilizzazione.
La liofilizzazione viene impiegata per ottenere una stabilità di conservazione a lungo termine dei prodotti alimentari e altri materiali biologici (colture microbiche, enzimi, vaccini, costituenti del sangue e medicinali).
In questo caso, l’obiettivo si concentra sull’arresto di reazioni biologiche e chimiche responsabili della degradazione nel materiale umido per mezzo della riduzione dell’attività dell’acqua nel prodotto.
In alcuni casi, specialmente per i materiali biologici sopra citati, è necessario inoltre che l’attività biologica inerente venga preservata seguendo il processo di essiccazione e, successivamente, che sia recuperabile al momento della reidratazione.
Il mantenimento dell’attività biologica è pertanto un requisito supplementare oltre alla stabilità di conservazione a lungo termine.
Un obiettivo alquanto diverso della liofilizzazione è la preparazione di campioni di tessuto per la microscopia elettronica.
Tabella 2: Alcuni materiali tipici essiccati mediante liofilizzazione
|
|
In questo caso è essenziale che la struttura del tessuto resti invariata nel processo di essiccazione.
La liofilizzazione può essere anche utilizzata in alcuni tipi analisi chimiche quando si desidera ottenere un campione sotto forma di polvere secca, o per rispettare requisiti del sistema di analisi “senza acqua”, o per concentrare il prodotto prima dell’esame, aumentando in questo modo la sensibilità dell’analisi.
In questo caso, è essenziale che nel processo di liofilizzazione il campione non cambi la composizione chimica a causa dell’instabilità dei componenti del campione. Questo obiettivo può imporre requisiti severi sulle condizioni di essiccazione impiegate.
Un’altra applicazione simile della liofilizzazione è il recupero di intermedi di reazione da sistemi di reazione con diluizione, specialmente laddove ulteriori fasi di reazioni vengono eseguite al meglio a concentrazioni più elevate. In questo caso, la preservazione dell’attività chimica e/o biologica è un requisito essenziale per l’accettazione del processo di essiccazione.
Dagli esempi sopra menzionati, è possibile notare che le varie destinazioni d’uso finali del prodotto impongono diversi requisiti al processo come ad esempio il mantenimento dell’attività biologica, della struttura fisica, la prevenzione di mutamenti chimici nella conservazione, ecc.
Pertanto, nella successiva osservazione di questo processo, è importante tenere a mente che è il prodotto a determinare quale dei metodi di liofilizzazione possibili può essere impiegato e quali sono le condizioni di processo possibili.
Più avanti vedremo in che modo agiscono le proprietà del prodotto ed i requisiti legati al suo uso sopra menzionati nel determinare le condizioni che possono essere impiegate nella preparazione del prodotto liofilizzato.
Vi sono diversi metodi di essiccazione che possono essere impiegati per preparare materiali essiccati. Alcuni sono più adatti per la produzione industriale su vasta scala, altri per usi in laboratorio, mentre altri ancora sono adatti in teoria per entrambi gli usi. Qui di seguito sono elencati vari metodi ed il loro relativo settore principale di impiego.
Abbiamo già menzionato la liofilizzazione come metodo per la preparazione di materiali essiccati. Alcuni dei metodi di essiccazione elencati sono più adatti per i liquidi (per esempio: essiccazione spray, a tamburo o essiccazione con sistema roller) mentre altri sono più adatti per solidi (essiccazione pneumatica, a letto fluido, a tunnel o a camera).
La liofilizzazione è piuttosto particolare essendo adatta sia per i solidi, sia per i liquidi. E questo grazie ai principi fisici su cui si basa. Questo argomento, le basi fisiche della liofilizzazione, costituirà una parte importante del resto del testo principale.
Questi attributi particolari sono importanti per spiegare la vasta gamma di applicazioni della liofilizzazione nell’ambiente di laboratorio; tuttavia, è anche indispensabile notare che l’ampio consenso riscontrato dal processo di liofilizzazione è dovuto essenzialmente alla facilità con cui la liofilizzazione può essere condotta in laboratorio, anche da personale senza una particolare conoscenza del processo.
Tabella 3: Esempi di processi di essiccazione
|
|
|
(I) = industria, (L) = laboratorio, (I,L) = sia laboratorio che industria
Mentre è possibile liofilizzare dei campioni senza sapere molto sulla liofilizzazione, lo scopo del presente fascicolo è quello di fornire vari livelli di preparazione; dall’operatore del processo di liofilizzazione al project manager, e di fornire una migliore comprensione di questo processo e soprattutto di comprendere la relazione delle condizioni di processo rispetto alle proprietà del prodotto, in modo da ottenere una più completa comprensione di entrambe queste opportunità nonché dei limiti associati alla liofilizzazione.

Un’analisi iniziale
La liofilizzazione è un processo a tre fasi.
Nella prima fase, il prodotto viene congelato allo stato solido in modo tale che l’acqua presente nella materia si trasformi in ghiaccio. (In realtà, una piccola porzione dell’acqua è fortemente legata dai solidi e non si congela – maggiori informazioni al riguardo sono disponibili nei supplementi).
Nella seconda fase del processo di liofilizzazione il ghiaccio formato nella fase di congelamento viene rimosso tramite la trasformazione diretta da solido a vapore per mezzo di un processo chiamato sublimazione.
Nella terza fase del processo, l’acqua che era fortemente legata ai solidi del campione (chiamata acqua adsorbita) viene trasformata in vapore ed estratta dal prodotto. Questo processo viene definito desorbimento.
Differenze principali tra la liofilizzazione e gli altri processi di essiccazione:
In tutti gli altri processi di essiccazione l’acqua è presente nella materia allo stato liquido, e la rimozione dell’acqua avviene tramite evaporazione (es. l’acqua si trasforma dallo stato liquido in vapore).
La mobilità dell’acqua allo stato liquido nella maggior parte dei processi di essiccazione rispetto all’immobilità dell’acqua allo stato solido (ghiaccio) durante la liofilizzazione ha importanti conseguenze sulle proprietà del prodotto essiccato ottenuto.
Inoltre, anche le differenze piuttosto notevoli dei livelli di temperatura a cui l’acqua si trasforma in vapore sono importanti.
Il processo di sublimazione (nella liofilizzazione) avviene a basse temperature (generalmente a circa -20°C fino a -30°C), laddove per l’evaporazione dell’acqua liquida la temperatura per il passaggio dalla stato liquido a quello gassoso è più alta e compresa tra +50°C e +100°C.
In situazioni in cui l’integrità dei componenti della materia essiccata è importante, come per la preparazione di sezioni di tessuto essiccato per analisi microscopiche, la liofilizzazione rappresenta una scelta logica.
In casi in cui la stabilità chimica o la preservazione dell’attività biologica è importante, la scelta di condizioni di basse temperature per la rimozione della maggiore quantità di acqua dal prodotto impone di optare per la liofilizzazione.
Il motivo per cui la liofilizzazione non è ritenuta ottimale per tutte le situazioni di essiccazione è da ricondursi principalmente a considerazioni economiche (sia in termini di investimento sia di costi di gestione), essendo i costi della liofilizzazione generalmente maggiori rispetto a quelli di altri processi di essiccazione.
Quindi, per i casi in cui fattori specifici prodotto-qualità risultano di minore importanza è possibile che il costo maggiore della liofilizzazione non sia giustificato. (Per situazioni di laboratorio, considerazioni di costi di gestione non sono generalmente significative).
Come abbiamo visto in precedenza, (Tabella 1), vi sono molte aree in cui requisiti particolari legati al prodotto richiedono l’uso della liofilizzazione se si desidera ottenere un prodotto dalla qualità soddisfacente.
Nei capitoli seguenti verrà esaminato il processo di liofilizzazione più in dettaglio e messo in relazione con le proprietà dei materiali da liofilizzare.
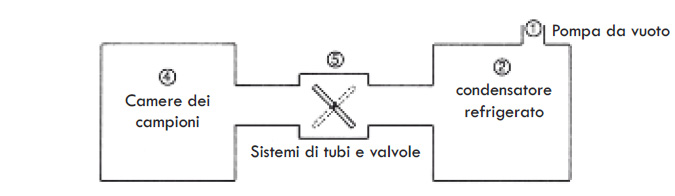
Ma prima di tutto esamineremo la struttura fisica di un liofilizzatore tipico, che probabilmente il lettore già possiederà nel proprio laboratorio.
Nel descrivere un liofilizzatore tipico si deve osservare per prima cosa che, sebbene tutti i liofilizzatori siano costituiti dagli stessi componenti di base, essi possono variare notevolmente in termini di dimensione ed aspetto.
Anche se si dovesse tentare di individuare le differenze tra i liofilizzatori da laboratorio e quelli industriali, verrebbe subito alla luce che un liofilizzatore impiegato per la produzione alimentare con una capacità di tonnellate al giorno, ad esempio per la produzione di caffè liofilizzato, opera sostanzialmente seguendo lo stesso principio di un liofilizzatore da laboratorio per la preparazione di pochi grammi al giorno di campioni di tessuto destinati all’analisi al microscopio.
Essendo questo fascicolo destinato principalmente a persone che utilizzano liofilizzatori da laboratorio, gli esempi qui presi in esame si baseranno su un sistema da laboratorio. La figura 1 mostra una serie di liofilizzatori da laboratorio di diverse dimensioni e aspetti.
Per questa analisi, ci concentreremo su un singolo modello, il piccolo liofilizzatore in primo piano, poiché mostra chiaramente tutti gli elementi di
base di un liofilizzatore tipico.
Sulla sinistra si può osservare la pompa a vuoto (1), collegata mediante un tubo ed una valvola ad un sistema di condensatore refrigerato (2) che estrae l’acqua.
Sulla parte anteriore del liofilizzatore, vi sono una serie di dispositivi di controllo e di misurazione (3), ed infine una serie di di camere per campione (4), alcune delle quali sono collegate al condensatore per mezzo di tubi e sistemi di valvole (5).
Tutti I liofilizzatori mostrati sono costituiti dagli stessi componenti di base, sebbene nella maggior parte dei casi, la pompa a vuoto ed il condensatore refrigerato siano nascosti per motivi estetici nell’alloggiamento sotto la camera.
Possono essere impiegati molti tipi di sistemi di tubi e valvole (5) per collegare varie camere al condensatore refrigerato. Alcuni collegamenti sono piuttosto lunghi e possono presentare una geometria complessa.
|
|
|
Il liofilizzatore tipico può essere visualizzato in un grafico semplice (fig. 2) dove i numeri indicati corrispondono ai componenti sopra citati. Nel Supplemento C sono impiegati grafici simili per descrivere il trasferimento di materia legato alla liofilizzazione.
In precedenza abbiamo visto che il campione è composto da due componenti principali, acqua e solidi. Ognuno di questi componenti è importante per determinare il modo in cui il campione si comporta durante la liofilizzazione. Pertanto, sia la conoscenza generale sia quella specifica del prodotto - relative alle proprietà dell’acqua e dei solidi - sono importanti per eseguire con successo un processo di liofilizzazione.
In questo capitolo, prenderemo in esame alcuni aspetti base delle proprietà generali dell'acqua e dei solidi.
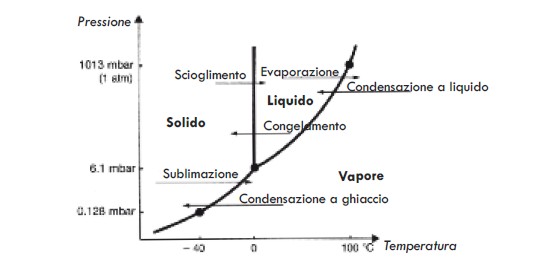
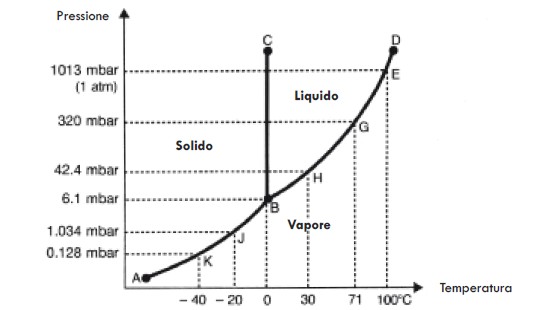
Acqua: - L’acqua può esistere in tre forme (chiamate stati) definite stato solido (come il ghiaccio), liquido (come il solvente nel nostro campione) e gassoso (come il vapore). Lo stato dell’acqua pura dipende in ogni momento dalla sua temperatura e pressione nel sistema. Se nell’acqua sono presenti solidi, la composizione del campione avrà un effetto sullo stato dell’acqua. Le varie relazioni tra gli stati dell’acqua sono indicate nei relativi grafici di stato. Due sono particolarmente interessanti: il grafico temperatura-pressione dell’acqua pura (Figura 3) e quello che descrive la composizione al variare della temperatura (Figure 4a e 4b). Questi grafici sono esaminati più approfonditamente nel Supplemento A. Si noti che per cambiare lo stato dell’acqua è necessario fornire o sottrarre energia alle molecole dell’acqua.
Abbiamo già visto che nella liofilizzazione sono importanti diversi cambiamenti dello stato dell’acqua. Uno è il congelamento dell’acqua (un cambiamento dallo stato liquido a quello solido) mentre un altro passaggio è la sublimazione (un cambiamento dallo stato solido allo stato gassoso). Il trasferimento di energia necessario per questi passaggi di stato dell’acqua è alquanto diverso. Ad esempio: per congelare un grammo d’acqua è necessario sottrarre all’acqua 80 calorie, mentre per sublimare un grammo di ghiaccio devono essere fornite al ghiaccio 680 calorie.
Nel processo di liofilizzazione il congelamento dell’acqua si verifica a pressione atmosferica (magari in un congelatore a pozzetto, ecc.) e quindi la temperatura del cambiamento di stato (dallo stato liquido allo stato solido) è il ben noto punto di congelamento dell’acqua (0°C).
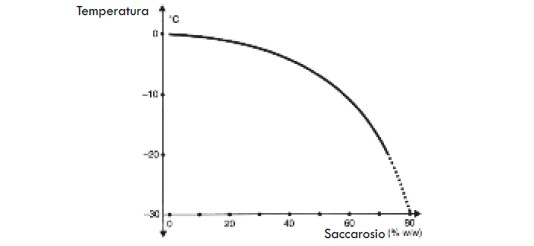
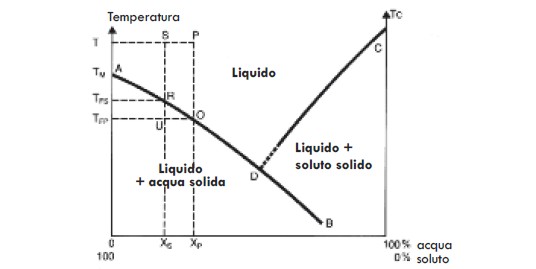
Poiché solitamente non liofilizziamo l’acqua, la nostra attenzione si sposta piuttosto sulla presenza di solidi nel campione, che hanno un effetto sulla temperatura alla quale l’acqua liquida si congela trasformandosi in solida. L’effetto dei solidi aggiunti sul punto di congelamento è indicato dal relativo grafico (Fig. 5) che proviene dalla Fig. 4. I grafici del punto di congelamento sono descritti in dettaglio nel Supplemento A.
A questo punto possiamo semplicemente notare che il raffreddamento di una soluzione sotto il punto di congelamento provoca la formazione di acqua solida (ghiaccio). L’acqua liquida restante non congelata contiene ancora tutti i solidi iniziali e pertanto possiamo notare che il congelamento di questa acqua in ghiaccio produce allo stesso tempo un aumento della concentrazione di solidi nel liquido rimanente non congelato. Nel momento in cui la temperatura diminuisce sempre di più, si forma una quantità sempre crescente di ghiaccio e, contemporaneamente, rimane sempre meno liquido non congelato. Osserviamo anche che maggiore è la quantità di solidi presente all’inizio (ovvero maggiore è la concentrazione di solidi nel campione originale), minore è la quantità di ghiaccio e maggiore la quantità di liquido ad ogni temperatura data del campione.
Quando si liofilizza a temperature molto basse, si osserva che la materia mostra uno o due tipi diversi di comportamenti di congelamento.
In alcune soluzioni (chiamate eutectic former), il liquido si solidifica improvvisamente ad una temperatura che dipende dalla composizione dei solidi nel campione. Per le soluzioni NaCl, detta temperatura è -21,6°C, mentre è molto più bassa per CaCl2, ovvero circa -55°C.
Nell’altro tipo di soluzioni (chiamate glass former), il liquido non si solidifica, ma piuttosto aumenta di viscosità, fino a diventare molto rigido e viscoso. Queste differenze nel comportamento di congelamento saranno importanti nelle successive analisi sulla possibilità di ottenere un'ottima liofilizzazione di materiali diversi.
Nel caso del passaggio di stato detto sublimazione, lo stato liquido è assente.
Proprio come molti ricordano che il punto di ebollizione dell’acqua allo stato liquido a pressione atmosferica è di +100°C, coloro che lavorano nel campo della liofilizzazione sanno che i valori importanti tipici per la sublimazione per il ghiaccio sono 1 mbar a -20°C e 0,128 mbar a -40°C. Ciò significa, ad es., che il ghiaccio in sublimazione, avendo una temperatura di -20°C forma vapore con una pressione di 1 mbar. Un elenco più completo di temperature e pressioni è riportato in Tabella 4.
Queste relazioni di temperatura e pressione sono particolarmente importanti per comprendere il trasferimento di materia (il movimento dell’acqua dal campione al condensatore) in un liofilizzatore.
Tabella 4: Relazione tra temperatura e pressione del vapore acqueo
| Temperatura (°C) | Pressione del vapore acqueo (mbar) |
|---|---|
| 30 | 42.421 |
| 20 | 23.374 |
| 10 | 12.275 |
| 0 | 6.103 |
| -10 | 2.599 |
| -20 | 1.034 |
| -30 | 0.381 |
| -40 | 0.128 |
| -50 | 0.039 |
| -60 | 0.010 |
| -70 | 0.025 |
| -80 | 0.0005 |
Solidi: - Per prima cosa si noti che, nell'esaminare i solidi in un campione e la loro influenza sulla liofilizzazione, è necessario includere tra i “solidi” anche le molecole d’acqua direttamente associate/legate.
Nella liofilizzazione sono importanti alcuni fattori legati alla materia per ottenere un prodotto di alta qualità. Sono i cosiddetti fattori di stabilità e possono essere divisi un due gruppi principali: stabilità strutturale e stabilità chimica. Le proprietà del materiale, relative a questi fattori di stabilità, determinano la qualità della liofilizzazione di un prodotto.
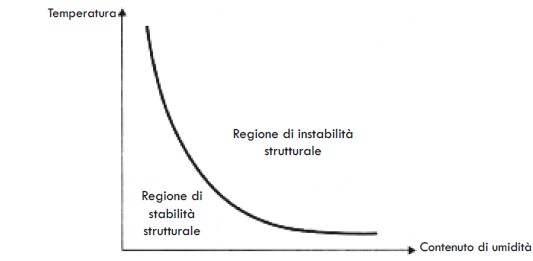
La stabilità strutturale di un materiale è legata alla propria capacità di essere sottoposto a liofilizzazione senza subire cambiamenti fisici, in particolare per quanto riguarda la dimensione e la forma.
La proprietà del materiale più strettamente legata alla stabilità strutturale può essere chiamata rigidità. Questa proprietà descrive in modo particolare la capacità del materiale di sopportare il proprio peso e resistere all’influenza delle forze esterne sulla propria geometria.
Per un dato materiale, la rigidità dipende dalla sua temperatura e dal contenuto di umidità (Figura 6).
In questo caso abbiamo visto che per un determinato materiale vi è un’ampia varietà di combinazioni di temperatura-contenuto di umidità che dà luogo alla stabilità o all’instabilità della struttura.
Un materiale diverso avrà altre combinazioni di temperatura e contenuto di umidità, determinandone le aree di stabilità o instabilità.
La rigidità relativa dei diversi materiali dipende sia dal peso molecolare sia dalla struttura molecolare (in particolare dai loro tipi di legame).
I solidi con peso molecolare inferiore o con bassi livelli di legami di formazione, con temperature dei campioni e contenuti di umidità maggiori, tendono tutti a fornire minore rigidità alla materia.
Il comportamento del campione durante la liofilizzazione può dipendere dal fatto che i solidi siano eutectic former o glass former durante il congelamento, poiché queste due forme possono differire notevolmente in quanto a rigidità. Questi punti verranno ripresi più avanti nel capitolo 10 e nei Supplementi.
I materiali che possiedono una stabilità strutturale scarsa finiscono generalmente per rinsecchirsi o per gonfiarsi, o assumere un aspetto vitreo e diventare appiccicosi. Di questi campioni si dice che sono collassati durante la liofilizzazione. La stabilità strutturale scarsa (collasso) nella liofilizzazione, oltre a richiedere un maggior tempo di essiccazione, produce anche un prodotto di scarsa qualità.
Tabella 5: Temperature per le transizioni di struttura, °C
| Collasso durante la liofilizzazione | |||||
|---|---|---|---|---|---|
| Succo di mela | -42 | Maltosio | -32 | Glucosio | -40 |
| Tampone citrato | -40 | Methocel | -9 | Inisitolo | -27 |
| Estratto di caffè | -20 | MSG | -50 | Lattosio | -32 |
| Destrano | -9 | Succo d'arancia | -24 | PVP | -23 |
| Fruttosio | -48 | Albume | -10 | Saccarosio | -32 |
| Gelatina | -8 | Tampone fosfato | -80 | Sorbitolo | -45 |
| Succo di limone | -36 | ||||
| Collasso del materiale essiccato | |||||
| Fruttosio | 37 | Maltosio | 96 | Maltodestrina (DE=10) | 226 |
| Glucosio | 35 | Maltotriosio | 88 | Maltodestrina (DE=10) | 174 |
| Lattosio | 101 | Succo d'arancia | 52 | Maltodestrina (DE=25) | 150 |
| Saccarosio | 56 | Xilosio | 24 | ||
Mentre alcuni materiali sono nella pratica classificati come materiali molto difficili da liofilizzare, in teoria tutti i materiali possono essere liofilizzati. Si tratta “solo” di scegliere le giuste condizioni di liofilizzazione adatte alle proprietà particolari del materiale da liofilizzare.
I livelli di temperatura critici nella liofilizzazione per una serie di materiali (chiamate temperature di collasso) sono indicati nella Tabella 5. Per liofilizzare senza provocare una perdita strutturale è necessario mantenere le temperature nelle zone di congelamento del campione al di sotto queste temperature di collasso.
I liofilizzatori normalmente disponibili in commercio non riescono a raggiungere le condizioni di processo richieste dalle proprietà del materiale (come ad esempio la temperatura di collasso a -48°C per il fruttosio), e si deve accettare il fatto che (1) la materia non può essere liofilizzata con stabilità strutturale (sebbene possa essere liofilizzata senza stabilità strutturale), o (2) che è necessario costruire un'apparecchiatura speciale, forse molto dispendiosa, al fine di ottenere la liofilizzazione.
Tabella 6: Reazioni chimiche che influenzano la stabilità dei materiali liofilizzati:
|
|
|
Relativamente alla liofilizzazione, l’area della stabilità chimica è molto ampia a causa dell’elevato numero di materiali che vengono liofilizzati e della serie di reazioni chimiche che possono verificarsi. Per una serie di reazioni (come ad esempio la sopravvivenza microbica), si ha una scarsa comprensione di questi meccanismi di reazione. Alcune delle reazioni non si manifestano durante la liofilizzazione, ma piuttosto durante la conseguente conservazione del prodotto essiccato.Oltre alla composizione chimica del campione, gli altri fattori cha esercitano un’influenza significante sulla stabilità chimica del materiale sono la temperatura ed il contenuto di umidità del materiale stesso. È generalmente noto che la velocità di reazione chimica aumenta con l’aumentare della temperatura e cala con la diminuzione del contenuto di umidità (nonostante si sia a conoscenza di alcune eccezioni relative all’influenza dell’umidità). Durante la liofilizzazione, il campione mostra temperature e contenuti di umdità ampiamente variabili, la cui entità dipende dalle condizioni di elaborazione scelte.
Per raggiungere l’obiettivo di una buona liofilizzazione, le condizioni del processo devono prendere in considerazione le proprietà del materiale relative alla sensibilità alle reazioni chimiche.
I fattori di stabilità (sia strutturali che chimici) del materiale sono importanti nel momento in cui si impongono dei limiti alle condizioni di funzionamento del nostro liofilizzatore.
Queste riflessioni saranno riprese nei capitoli 10 e 11 e nei Supplementi.
Il trasferimento è il movimento di qualcosa da un punto ad un altro. Per la liofilizzazione i trasferimenti importanti sono 2: il trasferimento di materia (movimento di “cose”) e il trasferimento di calore (movimento di energia).
Quando si osserva il comportamento del trasferimento nella liofilizzazione, l’interesse si sposta alla rapidità con cui avviene il movimento del calore o della materia. Possiamo definirla velocità di trasferimento e deve essere controllata tramite due fattori.
Uno di questi fattori tende dar luogo al trasferimento, ed è chiamato forze motrici, mentre l'altro fattore tende ad impedire il verificarsi del trasferimento, e si tratta delle resistenze.
La velocità del movimento del nostro “qualcosa” dipende dal rapporto
forze motrici
resistenze
Una velocità elevata di trasporto può derivare quindi da un’elevata forza motrice, da una resistenza ridotta o da una combinazione di ognuna di esse. Tuttavia, è bene notare che senza una forza motrice non vi sarebbe trasferimento, anche se la resistenza fosse a zero.
Trasferimento di materia (vedere anche Supplemento C)
Il trasferimento della materia è il movimento della materia da un luogo ad un altro. Nella liofilizzazione ciò che ci interessa è il movimento dell’acqua, in particolare dal nostro prodotto al condensatore del liofilizzatore.
Nella liofilizzazione, la forza motrice per il trasferimento di materia è la differenza di pressione, mentre le resistenze nascono dall’attrito tra le molecole d’acqua in movimento da un lato e (1) da altre molecole d’acqua in movimento, da (2) molecole d’aria nel liofilizzatore e (3) le pareti dei tubi e delle valvole del liofilizzatore dall’altro.
Abbiamo già visto che l’acqua a temperature diverse presenta pressioni differenti e, in particolare, il ghiaccio a -40°C presenta una pressione inferiore rispetto al ghiaccio a -20°C (cfr. Figura 3 o Tabella 4).
Pertanto, collegando uno spazio raffreddato a -40°C tramite un refrigeratore con un altro spazio in cui il prodotto si trova a -20°C, si ottiene una differenza di pressione tra i due spazi (Figura 7). Questa differenza (forza motrice) provoca un movimento delle molecole dell’acqua dal campione con pressione maggiore verso lo spazio refrigerato con pressione minore (spazio chiamato condensatore poiché ricondensa il vapore acqueo in ghiaccio).
Una serie di fattori di resistenza ostacola il flusso delle molecole d’acqua. Le molecole dell’acqua tendono a muoversi in rettilineo fino a quando non urtano qualcosa, rimbalzando qundi in un’altra direzione.
Maggiore è il numero delle volte in cui urtano un ostacolo (un’altra molecola d'acqua, aria, pareti delle tubature o curvature, o le piccole aperture delle valvole), maggiore è la difficoltà a muoversi nella direzione desiderata. In tal caso, il nostro sistema presenta un’elevata resistenza al flusso dell’acqua.
In Figura 7 sono illustrate due configurazioni di tubi per il collegamento della camera del campione con la superficie refrigerata.
Il tubo superiore, rettilineo e di diametro ampio, provoca poche collisioni tra le molecole e le pareti e rappresenta quindi una percorso a bassa resistenza rispetto al tubo inferiore con diametro ridotto, molte curvature e una valvola in parte chiusa.
Nella liofilizzazione vi sono limiti alle differenze di pressione che si possono raggiungere. Secondo la teoria, il condensatore non può avere una pressione inferiore allo zero assoluto (vuoto perfetto) mentre la pressione del ghiaccio del prodotto è limitata, in pratica, dalle proprietà di scioglimento, definendo così una temperatura ed una pressione massime per la regione del campione. Pertanto, è alquanto importante mantenere più basse possibili le resistenze del trasferimento di materia.
L’eliminazione dell’aria e dei gas non condensabili è fondamentale, motivo per il quale c’è una pompa a vuoto collegata al sistema. Inoltre, le dimensioni del liofilizzatore dovrebbero riflettere l’entità dei carichi di trasferimento dell’acqua da posizionare sul sistema. In generale, i tubi dovrebbero essere corto e con diametri relativamente ampi. Le valvole dovrebbero essere a gola ampia e di numero ridotto. Inoltre, nelle tubature di collegamento le curvature brusche devono essere ridotte al minimo.
Torneremo su queste considerazioni fondamentali nel capitolo 11.
Trasferimento di calore(vedere anche Supplemento D)
Il trasferimento di calore è il movimento di energia. Il movimento di energia è fondamentale nella liofilizzazione poiché ogni volta che si verifica un cambiamento di stato dell’acqua (congelamento, sublimazione, desorbimento e condensazione) è necessario sottrarre o fornire energia alle molecole d’acqua. Ne consegue che senza trasferimento di calore (energia) non può esserci liofilizzazione.
La forza motrice per il trasferimento di calore è la differenza di temperatura da un punto ad un altro. L’energia si muove da vari punti di alta temperatura verso altri punti con temperature inferiori.
Le resistenze di trasferimento di calore dipendono dalla situazione fisica che, per semplicità d’analisi, può essere suddivisa in tre gruppi: conduzione, convezione e irraggiamento.
La conduzione è la modalità di trasferimento dell’energia nei solidi in cui non è possibile alcun movimento della materia.
La convezione è la modalità di trasferimento di energia nei liquidi, vapori e gas in cui l’energia viene trasportata dal movimento delle molecole nello spazio.
L’irraggiamento è la modalità di trasferimento di energia per mezzo della quale l’energia viene trasportata attraverso spazi “vuoti” (come ad esempio dal sole alla terra).
L’entità delle resistenze per queste tre modalità di trasferimento dipende da molti fattori.
Per la conduzione, la resistenza del trasferimento di calore dipende molto dalle proprietà termiche della materia. Il rame, ad esempio, possiede molta meno resistenza al trasferimento di calore rispetto alla schiuma di polistirene. Per questo motivo si utilizza il rame negli scambiatori di calore in cui si desidera un elevato trasferimento di calore e schiuma di plastica per l’isolamento dove si desidera un basso trasferimento di calore.
Nella liofilizzazione la conduzione è una modalità importante di trasferimento di energia, sia verso il campione dall'apparecchio, sia all’interno del campione stesso.
Per la convezione, il trasferimento di calore dipende molto dal numero di molecole disponibili per fornire l’energia. Nel liofilizzatore nel quale è stata eliminato tutta l’aria, il numero di molecole nello spazio è generalmente ridotto e la convezione risulta solitamente di scarsa importanza.
Nello spazio il numero di molecole è talmente basso che lo possiamo considerare quasi vuoto, ed in questo caso l’irraggiamento può essere una modalità significativa di trasferimento di calore.
In realtà, le combinazioni di trasferimento di calore per conduzione e irraggiamento sono alquanto comuni, sia per la progettazione o laddove un buon contatto termico necessario per la conduzione non venisse raggiunto. Le configurazioni tipiche sono mostrate in Figura 8.
Per il trasferimento di calore, la forza motrice può in teoria avere qualsiasi grandezza desiderata, ma in pratica, esistono limiti di temperatura oltre i quali il prodotto non deve essere sottoposto. Questi limiti di temperatura forniscono un livello massimo per la forza motrice del trasferimento di calore.
Alcune delle resistenze del trasferimento di calore sono sotto il nostro controllo (come ad esempio il grado di precisione di contatto del campione al supporto determinando così la grandezza di una delle resistenze di conduzione), mentre altre resistenze al trasferimento di calore sono meno controllabili (p. es. la resistenza relativa all’irraggiamento).
Per concludere questo capitolo, possiamo osservare che una serie di problemi pratici riscontrati nella liofilizzazione sono legati a considerazioni inadeguate relative al trasferimento di calore e di materia e soprattutto ad una mancata valutazione della relazione tra questi fenomeni di trasferimento e le proprietà del materiale del campione. Alcune delle considerazioni che dovrebbero essere avanzate nel determinare un processo di liofilizzazione ed alcuni dei problemi che possono nascere in quel momento saranno esaminate ulteriormente nel capitolo 11.
Abbiamo già visto nel capitolo 6 che la liofilizzazione è un processo costituito da tre fasi: congelamento, sublimazione e desorbimento .Prima di esaminare queste tre fasi in dettaglio, occorre fare una premessa.
In primo luogo, sebbene la liofilizzazione avvenga in tre fasi, è generalmente molto comune eseguire il congelamento in un congelatore a pozzo, in un bagno refrigerato o con azoto liquido, utilizzando strumenti non direttamente associati con l’apparecchio di liofilizzazione. In questi casi, solo le fasi di sublimazione e di desorbimento hanno luogo nello stesso liofilizzatore.
In secondo luogo, mentre tutti i punti nel campione completano la fase di congelamento prima di dare inizio alla fase di sublimazione, lo stesso non si può dire nel momento in cui si osserva la relazione tra le fasi di sublimazione e di desorbimento. Mentre in ogni punto nel campione la sublimazione precede il desorbimento, infatti, se consideriamo l’intero campione in una volta, alcune regioni si trovano nella fase di sublimazione, mentre altre già passate attraverso la fase di sublimazione si trovano in quella di desorbimento. Pertanto, anche se esaminiamo la sublimazione e il desorbimento come fasi separate, è importante comprendere che esse si presentano simultaneamente nel liofilizzatore in punti diversi nel campione.
La fase di congelamento
Come menzionato in precedenza, il congelamento spesso non avviene nel liofilizzatore ma in un apparecchio separato. La scelta si basa generalmente su fattori di costo e convenienza, sebbene considerazioni tecniche relative alle temperature di congelamento dovrebbero essere incluse nella scelta dei metodi di congelamento.
La fase di congelamento deve essere completata prima di dare inizio alla sublimazione e al desorbimento. Il congelamento ha tre effetti principali sul campione di grande importanza per la liofilizzazione. Tali effetti sono (1) disidratazione parziale del campione, (2) irrigidimento della struttura e (3) determinazione della morfologia del campione (p. es. struttura tridimensionale).
Nel processo di congelamento, l’acqua liquida nel campione si trasforma in ghiaccio. Dato che nel passaggio di stato da acqua liquida a ghiaccio si lascia una fase liquida contenente una quantità invariata di solidi dissolti in minor acqua, si dovrebbe dire che i solidi nel liquido rimanente sono diventati più concentrati, o al contrario, si dovrebbe considerare che i solidi sono parzialmente disidratati.
Dato che il ghiaccio formato è ancora presente nel campione, il congelamento provoca solo una separazione fisica dell’acqua (sotto forma di ghiaccio) dai solidi. La rimozione di quest’acqua (ghiaccio) dal campione avviene in primo luogo nella fase di sublimazione.
Inoltre, il fatto che il ghiaccio sia ancora presente nel campione significa che la temperatura deve essere mantenuta sufficientemente bassa in modo tale che il campione resti congelato al momento del trasferimento dal dispositivo di congelamento al liofilizzatore.
In caso contrario, il ghiaccio si scioglierebbe e il grado di disidratazione parziale si ridurrebbe. Il grado di disidratazione parziale raggiunto durante il congelamento dipende dal tipo di materiale e dalla curva di temperatura del campione durante il congelamento; nel caso dei “glass” former, resterà sempre dell’acqua non congelata associata ai solidi (vedere anche Supplemento A).
La rigidità strutturale del campione congelato dipende dalla combinazione della rigidità delle regioni di ghiaccio e dalla rigidità delle regioni non congelate (soluzione concentrata). Il ghiaccio stesso è alquanto resistente alla deformazione agendo pertanto da supporto per le regioni non congelate la cui rigidità può essere molto più variabile. Le quantità relative di ghiaccio formato e di materia residua non congelata dipendono dalla temperatura del campione e dalla concentrazione iniziale dei solidi nel campione, di conseguenza l’efficienza del ghiaccio come struttura di sostegno generale dipende di conseguenza da questi fattori.
La rigidità della materia non surgelata (solidi più acqua non congelata fortemente legata) dipende dal peso molecolare della materia nonché dalla temperatura e dal contenuto di acqua del campione. Questa situazione è simile alla relazione mostrata nella Figura 6 ma nella regione di maggior contenuto di umidità. (Vedere Supplemento B per maggiori dettagli).
La morfologia del campione si riferisce alla distribuzione fisica dei componenti del campione nello spazio dopo il congelamento; ovvero si tratta della dimensione, collocazione e orientamento dei cristalli di ghiaccio formati dal processo di congelamento. La morfologia ottenuta in questo processo influenza la liofilizzazione ed alcune proprietà del prodotto liofilizzato.
La morfologia del campione dipende inoltre da diverse proprietà fisiche del campione (come ad esempio la concentrazione, la viscosità, la presenza di pareti di cellule o membrane, ecc.), nonché dalle condizioni di trasferimento di calore nella fase di congelamento.
In generale, possiamo vedere che mentre un congelamento più lento restituisce un numero inferiore di cristalli più grandi di ghiaccio che tendono ad essere più orientati in una direzione, il congelamento rapido restituisce un numero più elevato di piccoli cristalli di ghiaccio che non sono orientati in un’unica direzione (Figura 9).
Figura 9. Influenza della velocità di congelamento sulla morfologia dei cristalli di ghiaccio nel campione congelato.
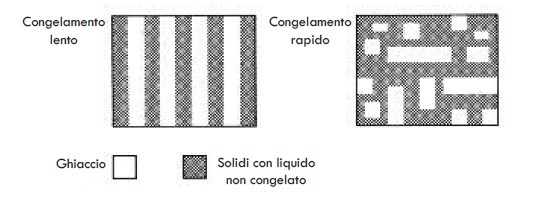
I campioni viscosi che hanno più scarse possibilità di trasporto d’acqua, restituiscono cristalli di ghiaccio più piccoli.
I campioni con cristalli di ghiaccio più piccoli e disorientati tendono ad avere una resistenza maggiore al trasferimento della materia nel campione durante la sublimazione. Questo porta ad un essiccamento più lento e ad alterazioni strutturali più sensibili nel campione nella fase di sublimazione.
Nonostante le riflessioni testè menzionate, la fase di congelamento deve essere scelta in modo tale da ottenere le proprietà richieste del prodotto.
Per esempio, per preservare la struttura fine del campione per l’analisi al microscopio è necessario usare un congelamento rapido al fine di minimizzare la dimensione dei cristalli di ghiaccio. Questo requisito legato al prodotto per la fase di congelamento indica che le condizioni rimanenti di liofilizzazione devono essere scelte considerando le resistenze più elevate del trasferimento di materia che si trovano in un tale campione.
In un altro caso, tentare di congelare o di liofilizzare una soluzione molto concentrata potrebbe risultare difficile, se non impossibile. In questo caso, potrebbe essere necessario diluire il campione prima del congelamento in modo tale che una giusta quantità di ghiaccio si formi nella fase di congelamento.
La fase di sublimazione
La fase di sublimazione elimina le molecole d’acqua che nella fase di congelamento sono state separate dai solidi in forma di cristalli di ghiaccio. La sublimazione non coinvolge l’acqua non congelata associata ai solidi (o sorbita) che viene rimossa per la prima volta nella fase di desorbimento.
Come visto in precedenza, la sublimazione è la trasformazione diretta dell’acqua solida in vapore acqueo. Per realizzare questa trasformazione è necessaria energia, il che significa che dobbiamo avere il trasferimento di calore ai cristalli di ghiaccio se vogliamo che si formi del vapore. Successivamente, la rimozione di questo vapore viene gestita dalle condizioni di trasferimento della materia presenti nel sistema.
Al fine di rimuovere il vapore acqueo formato, è necessario un percorso dal cristallo di ghiaccio alla superficie del campione. Ciò significa che la sublimazione inizia sempre in una superficie aperta per poi spostarsi successivamente all’interno del campione.
Dopo la sublimazione del ghiaccio il campione può essere diviso in due regioni, lo strato essiccato (dal quale i cristalli di ghiaccio hanno sublimato) e lo strato congelato (dove i cristalli di ghiaccio sono ancora presenti).
Il punto di incontro di queste due regioni viene chiamata interfaccia di ghiaccio, interfaccia di sublimazione, interfaccia di liofilizzazione o semplicemente interfaccia.
Sull’ interfaccia il contenuto d’acqua subisce un drastico cambiamento da quello nella regione congelata (quello del materiale originale) a quello nello strato essiccato (a partire da circa 25 -30% di acqua fino a 0-3% d’acqua). La Figura 10 mostra il movimento dell’interfaccia del ghiaccio e la distribuzione restante di umidità tra lo strato congelato e gli strati essiccati
Figura 10. Distribuzione del contenuto di umidità e relativi grafici schematici che mostrano gli strati essiccati e congelati a varie fasi della liofilizzazioni.

In realtà, la distribuzione dell’umidità è più complessa.
È anche qui sull’interfaccia che l’effetto di supporto della struttura del ghiaccio cessa a causa della sua eliminazione mediante sublimazione.
Questo processo lascia una struttura porosa ed aperta composta da solidi e acqua associata. Il mantenimento di questa struttura porosa ed aperta dipende ora esclusivamente dalla rigidità dei solidi non congelati.
Per far sì che la sublimazione abbia luogo nell’interfaccia, l’energia necessaria per la trasformazione solido-vapore deve essere trasportata attraverso il campione all’interfaccia.
Questo richiede differenze di temperatura tra alcune fonti di calore e l’interfaccia, definite gradienti di temperatura. La grandezza del gradiente (ovvero la differenza di temperatura) necessaria per fornire una data quantità di perdita d’acqua dipende dalle resistenze al trasferimento di calore presenti nel sistema.
Lo strato congelato presenta una resistenza di trasferimento di calore molto più bassa rispetto allo strato poroso essiccato, pertanto sono necessari dei gradienti di temperatura molto più bassi per il trasferimento di calore attraverso lo strato congelato rispetto a quello attraverso lo strato essiccato. Poiché la superficie dello strato essiccato deve essere aperta in modo tale che il vapore acqueo possa essere eliminato dall’interfaccia, il trasferimento di calore a questa superficie dalla fonte di calore deve avvenire per irraggiamento. Il trasferimento di calore dalla superficie attraverso lo strato essiccato avviene principalmente per conduzione lungo i solidi.
Il trasferimento di calore attraverso lo strato congelato avviene anche tramite conduzione, sebbene questo trasferimento dalla fonte di calore alla superficie dello strato congelato possa avvenire anche per conduzione, convezione o irraggiamento, a seconda della configurazione del liofilizzatore. La Figura 11 (a pagina seguente) mostra esempi schematici dei gradienti di temperatura e di pressione nel campione liofilizzato con trasferimenti di calore ideali per conduzione o irraggiamento. Si noti anche che il campione è diviso in strati essiccati e congelati.
Dopo la formazione del vapore sull’interfaccia, questo deve essere trasportato dal campione al condensatore refrigerato.
Ciò richiede il trasferimento di materia dall’interfaccia alla superficie del condensatore refrigerato e pertanto deve esserci una differenza di pressione, chiamata gradiente di pressione.
Figura 11. Flusso di materia e calore con i corrispettivi gradienti di temperatura e umidità per la conduzione e l’irraggiamento del calore.

Come si è visto in precedenza nella morfologia del campione, le resistenze del trasferimento di materia nel campione si determinano nel processo di congelamento. Poiché tutto il vapore che si è formato (determinato dall’entità del trasferimento di calore) deve essere rimosso, la pressione dell’acqua sull’interfaccia si stabilisce ad un livello relativo alla pressione del condensatore refrigerato, in modo tale che il conseguente trasferimento di vapore fuori dall’interfaccia bilanci la quantità di vapore formatosi sull’interfaccia grazie al trasferimento di calore.
Qui si evidenzia un potenziale problema dovuto alle condizioni di equilibrio mostrate in Figura 3: un aumento della pressione dell’acqua in corrispondenza dell’interfaccia provoca anche un incremento della temperatura del ghiaccio e la stabilità strutturale della materia dipende in larga misura da questa temperatura dell’interfaccia. È in questo modo che un aumento del trasferimento di calore al campione può provocare una perdita della struttura del campione.
Come si è visto in precedenza, i fattori di stabilità di un materiale impongono dei limiti alle condizioni di liofilizzazione che possono essere impiegate. Per eseguire la fase di sublimazione, infatti, è necessario trasferire energia ai cristalli di ghiaccio e rimuovere il vapore formato. Per far ciò, è necessario stabilire i gradienti della temperatura e della pressione dell’acqua che, se non ben selezionati tenendo in considerazione le proprietà di stabilità del materiale da liofilizzare, causano un’alterazione delle proprietà del prodotto. In particolare, se si desidera mantenere tali proprietà, in genere è necessario limitare l’intensità di trasferimento di calore all’interfaccia.
In alcuni casi, tuttavia, condizioni non indonee al trasferimento di materia (come per esempio il tentativo di far passare una quantità eccessiva di vapore in un tubo lungo con diametro ridotto) danno luogo ad un comportamento di scarsa liofilizzazione, anche quando il trasferimento di calore non è stato aumentato di proposito.
In ultimo, vi sono alcuni materiali sensibili a causa della propria rigidità che sono quasi impossibili da liofilizzare senza perdita di struttura. Alcuni di questi punti verranno esaminati più in dettaglio nel capitolo 11.
La fase di desorbimento
Nella fase di sublimazione appena descritta sono stati eliminati i cristalli di ghiaccio che si erano formati nella fase di surgelamento dal campione. Quando un cristallo di ghiaccio viene eliminato ciò che rimane è la fase di soluto concentrato che definiamo lo strato essiccato. Alla fine del processo, questo diventa il nostro materiale liofilizzato.
Subito dopo il passaggio dell’interfaccia, tuttavia, questi solidi nello strato “essiccato” contengono ancora una notevole quantità d’acqua (generalmente circa 25-30 g d’acqua / 100 g solido), ovvero l’acqua fortemente legata non congelata menzionata precedentemente nel processo di surgelamento.
La maggior parte dei campioni non è strutturalmente o chimicamente stabile se non viene rimossa gran parte questa acqua (chiamata acqua sorbita). Il processo di rimozione di questa acqua fortemente associata viene chiamato desorbimento.
Quando parliamo di acqua sorbita, associata o legata, ci si riferisce all’acqua che esercita una pressione minore rispetto a quella esercitata dall’acqua liquida alla stessa temperatura. Questa riduzione di pressione è causata dal legame dell’acqua ai solidi, la cui forza determina l’intensità della riduzione della pressione.
Poiché la forza del legame acqua-solidi aumenta con il diminuire dell’acqua associata per unità di solidi, la pressione esercitata dall’acqua diminuisce con l’essiccamento graduale del prodotto.
Esistono grafici (Figure 12a e 12b), chiamati isoterme di assorbimento, che indicano la relazione tra la pressione dell’acqua e il contenuto idrico della materia ad una data temperatura (Figura 12a).
La pressione dell’acqua è spesso espressa in una forma normalizzata in base alla pressione dell’acqua (vapore) sull’acqua pura alla stessa temperatura. La pressione normalizzata dell’acqua viene definita attività dell’acqua (Aw= p/po) e le isoterme dell’assorbimento utilizzano generalmente questa rappresentazione (Figura 12b).
Un materiale ha valori di isoterme di assorbimento diversi con il variare della temperatura, così che ad ogni livello di umidità del campione, la pressione dell’acqua aumenta con l’aumentare della temperatura del campione.
La pressione dell’acqua esercitata dalle molecole dell’acqua sorbita è una della due pressioni che determinano la forza motrice del trasferimento della materia necessaria per rimuovere l’acqua sorbita.
L’altra pressione è la pressione dell’acqua nel condensatore refrigerato.
In teoria, il prodotto cessa di perdere acqua (ovvero si arresta il trasferimento della materia) quando la pressione dell’acqua nel campione equivale alla pressione dell’acqua nel condensatore essendo la forza motrice uguale a zero.
Utilizzando una serie di isoterme di assorbimento per il nostro materiale, per ogni temperatura del campione possiamo individuare il contenuto di umidità del materiale con il quale la pressione dell’acqua corrispondente equivale alla pressione dell’acqua del condensatore. Questo sarà il contenuto finale di umidità minimo teoricamente possibile per il campione a quella temperatura.
In realtà, il contenuto finale di umidità è maggiore a causa di una sostanziale diminuzione della velocità di perdita d’acqua poiché le differenze di pressione tra il campione e il condensatore sono in continua diminuzione. Se il contenuto finale di umidità non è sufficientemente basso da assicurare la stabilità del prodotto, è necessario modificare le condizioni di liofilizzazione affinché vi sia un ulteriore trasporto d’acqua dal campione.
Questa ulteriore perdita d’acqua può essere ottenuta in due modi (Fig. 13).
Figura 13. Effetto del cambiamento di temperatura nel campione e/o della temperatura del condensatore sul contenuto minimo possibile di umidità del campione.

Riassunto del capitolo 10
In questo capitolo abbiamo visto che il processo di liofilizzazione può essere suddiviso in tre fasi, la prima (surgelamento) nella quale l’acqua liquida viene divisa in due gruppi, ghiaccio (acqua solida) e acqua associata al soluto. La misura di questa divisione dipende dalla temperatura del campione e dalla composizione iniziale.
La seconda fase (sublimazione) riguarda la rimozione dei cristalli di ghiaccio tramite la trasmissione di energia che deve essere controllata in modo che il vapore prodotto possa essere rimosso senza dar luogo a condizioni che provocano la rottura strutturale, specialmente nell’interfaccia di sublimazione. In pratica, questo implica un controllo della temperatura di riscaldamento, sebbene alcune sostanze siano intrinsecamente difficili da liofilizzare.
La terza fase (desorbimento) richiede anch’essa una trasmissione di energia. Successivamente alla sublimazione dei cristalli di ghiaccio ad un determinato punto, l’acqua associata al solido si diffonde dalla regione della soluzione concentrata verso il percorso del vapore.
Il contenuto finale di umidità del campione viene raggiunto quando la pressione dell’acqua associata al solido equivale alla pressione dell’acqua nel condensatore.
Quando si deve scegliere un nuovo liofilizzatore, o quando se ne usa uno esistente, bisogna prendere in considerazione una serie di fattori che hanno un effetto importante sul successo del procedimento di liofilizzazione. Mentre molti di questi fattori sono stati menzionati in vari punti del testo, ora dobbiamo presentare direttamente alcune di queste considerazioni pratiche.
Considerazioni di base: Cosa vogliamo ottenere con il prodotto liofilizzato e perché lo stiamo liofilizzando?
Le seguenti domande dovrebbero essere le prime che dobbiamo porre.
Quale delle varie ragioni per cui si liofilizza sono più importanti per il prodotto in questione?
Quanto è importante la stabilità strutturale, o quanto è importante il mantenimento dell’attività biologica, ecc.?
Potremmo decidere, per esempio, di avere come obiettivo un’essiccazione a basse temperature senza modificazione chimica e stabilire che il mantenimento della struttura è di minore importanza. In questo caso, il tentativo di definire il processo di liofilizzazione in modo tale che mantenga anche la struttura, potrebbe dar luogo a complicazioni inutili.
La destinazione d’uso finale prevista del prodotto può avere anch’essa un’importanza nella scelta della migliore configurazione dell’apparecchio di liofilizzazione, specialmente per quanto riguarda la scelta delle camere e del supporto del campione. Questo punto verrà esaminato più avanti.
Considerazioni legate al materiale: Quali sono le caratteristiche del materiale in generale e del nostro campione in particolare?
Dopo aver messo in luce il motivo per cui si è optato per la liofilizzazione del campione, le prossime domande più importanti sono legate alle proprietà del materiale da liofilizzare. È importante avere informazioni circa la composizione chimica del campione e sulla concentrazione dei solidi. Queste informazioni sono importanti nella determinazione delle condizioni di liofilizzazione, necessarie per una corretta liofilizzazione del prodotto.
Fattori influenzati dalla composizione chimica del campione
Dalla sua composizione, si capisce se un campione è eutectic former o glass former. Gli eutectic former hanno temperature definite di perdita di struttura, mentre i glass former possiedono un comportamento più diffuso.
Le informazioni sulla composizione sono inoltre importanti per valutare i fattori di stabilità (strutturali e chimici) del prodotto, dato che dipendono direttamente dalla composizione chimica del campione.
Queste informazioni sono utili per determinare quali parametri del processo sono ammissibili durante l’essiccazione (principalmente livelli di temperatura) e durante la conseguente conservazione (livelli di temperatura e di umidità).
L’influenza della composizione del campione sull’instabilità chimica può essere mostrata considerando l’effetto dei gruppi amminici (come ammino-acidi o proteine) in un campione a base di carboidrati. La degradazione di Maillard del carboidrato si ha (così come una modificazione delle proprietà proteiche) quando il campione contiene gruppi amminici.
Analogamente, la presenza di carboidrati riducenti può ridurre potenzialmente la stabilità delle proteine (e allo stesso modo, degli enzimi) durante la liofilizzazione e la seguente conservazione.
È necessario porre dei limiti alle condizioni ammissibili per il processo di liofilizzazione se vogliamo evitare questo cambiamento chimico durante il processo.
La composizione chimica influenza anche la stabilità strutturale. La presenza di piccole quantità di materiali dall’elevato peso molecolare migliora notevolmente le probabilità di mantenimento della struttura durante la liofilizzazione.
Questo materiale dal peso molecolare più elevato può essere naturalmente presente nel campione, o potrebbe trattarsi di un componente da prendere in considerazione per aggiungerlo al campione principalmente composto da specie con sensibilità strutturale e con peso molecolare ridotto.
Inoltre, anche il contenuto di umidità al termine della liofilizzazione, necessario per la stabilità strutturale durante la conservazione, dipende dalla composizione del campione.
Fattori influenzati dalla concentrazione di solidi nel campione
La concentrazione iniziale del campione è importante poiché definisce la quantità di ghiaccio che si forma ad ogni temperatura di congelamento. Questo influenza la forza strutturale del materiale congelato ed in particolar modo la stabilità all’interfaccia. Poiché i percorsi per il flusso del vapore attraverso lo strato essiccato sono i punti dai quali i cristalli di ghiaccio hanno sublimato (cfr. Figura 10), le condizioni per l’eliminazione del vapore durante la sublimazione e il desorbimento dipendono dalla quantità di cristalli di ghiaccio formati e quindi dalla concentrazione iniziale del campione.
I campioni con concentrazione di solidi molto elevate e nei quali si forma poco ghiaccio sono difficili da liofilizzare a causa della ridotta stabilità all’interfaccia e al numero limitato di percorsi di vapore nello strato essiccato.
Possiamo anche affermare che i campioni con una concentrazione di solidi molto bassa, anche se tecnicamente non difficili da liofilizzare, possono essere di difficile recupero al termine del processo di liofilizzazione. In questo caso, la quantità di solidi presente è talmente ridotta che la struttura originale formata durante la separazione dei cristalli di ghiaccio non può sostenersi una volta che il ghiaccio ha subito la sublimazione. Quindi, in pratica, esisterebbero una concentrazione minima e una concentrazione massima di campione necessarie per ottenere una corretta liofilizzazione.
Un’ulteriore proprietà importante del campione è lo stato fisico del campione (ovvero, liquido o solido?) Questo è principalmente importante in base alle considerazioni di gestione del campione, come ad esempio la determinazione del tipo di contenitori che si possono usare, o il modo in cui il campione può essere congelato.
È importante comprendere le proprietà del campione originale e stabilire se queste dovrebbero essere alterate in modo tale da ottenere un materiale in grado di raggiungere l’obiettivo del prodotto.
In molti casi, non è necessario alterare il materiale per ottenere una corretta liofilizzazione, ma in alcuni casi, l’alterazione tramite la modifica della composizione e/o della concentrazione del campione è necessaria se il materiale deve essere liofilizzato correttamente alle condizioni di processo desiderate o meno.
Considerazioni legate al condensatore
Domande relative alla capacità: quanto deve essere grande il liofilizzatore di cui ho bisogno?
Il condensatore refrigerato come misura di capacità.
Quando si acquista un liofilizzatore ci si chiede sempre quanto deve essere grande. Mentre è possibile utilizzare vari criteri di dimensione, i liofilizzatori da laboratorio sono generalmente misurati dalla capacità del condensatore di contenere il ghiaccio (ovvero l’acqua dal campione). Questa capacità non dice niente sulla velocità con cui il vapore può essere trasportato nel condensatore, ma solo su quanto ghiaccio può contenere prima che sia necessario scongelarlo. Una volta che si conosce la concentrazione del campione è possibile calcolare la quantità di prodotto da sottoporre al processo prima che sia necessario scongelare il condensatore.
Poiché il liofilizzatore non può essere usato durante lo scongelamento (generalmente 2-4 ore o più, se il condensatore non ha il riscaldamento di scongelamento integrato), scongelamenti frequenti non sono auspicabili.
Del resto la capacità di condensazione ha un costo, così un condensatore troppo grande non è necessariamente la risposta. La capacità di condensazione deve essere almeno adeguata per gestire la quantità di prodotto da lavorare in un unico lotto, con un eccesso di capacità per le situazioni particolari. Ciò significa che la capacità di condensazione è legata alla capacità di supporto del prodotto della camera di essiccazione.
È possibile anche aggiungere più prodotto al liofilizzatore rispetto alla capacità di condensazione posseduta, per esempio continuando ad aggiungere elementi di rampa ad un sistema di liofilizzazione con delle rampe esterne. Una situazione simile può verificarsi inserendo un vassoio extra o due in una camera per campioni. Tale sovraccarico del sistema provoca un essiccamento incompleto del campione, a prescindere dalla durata della continuazione della liofilizzazione.
La grandezza del condensatore può essere maggiore di quella necessaria per un singolo lotto. In questo caso, è possibile eseguire diverse liofilizzazioni in sequenza prima di scongelare il condensatore.
In laboratorio questo procedimento può essere importante poiché gran parte della giornata lavorativa può essere impiegata per osservare il campione nelle fasi iniziali della liofilizzazione, invece di impiegare questo tempo per lo scongelamento.
Un’altra importante misura da prendere in considerazione per la capacità del liofilizzatore è la velocità alla quale il condensatore è in grado di sottrarre calore e quindi condensare il vapore. Se due liofilizzatori sono in grado di condensare 10 kg di ghiaccio tra i cicli di scongelamento, le possibilità di liofilizzazione sono diverse a seconda della loro capacità di condensare a 0,5 o 2,0 kg/h alla temperatura desiderata del processo di condensazione. Il sistema con la velocità maggiore di condensazione ha maggiore flessibilità, ma il costo dell’apparecchio è chiaramente più elevato. Per un condensatore con capacità di estrazione di calore fissata, maggiore è la quantità di vapore acqueo che il condensatore deve congelare in un dato tempo, maggiore è la temperatura (e di conseguenza la pressione) presente nel condensatore.
Possono esserci incrementi di velocità del trasporto di vapore acqueo al condensatore da diverse fonti (si vedrà in seguito), tutte legate all’aumento della velocità di produzione del prodotto (o liofilizzando più velocemente, o gestendo maggiori quantità di prodotto in una volta).
Per ottenere un gradiente di pressione adeguato dal campione al condensatore, è necessario assicurarsi che il condensatore abbia una capacità di rimozione del calore adeguata alle predette velocità del trasporto di vapore acqueo, in modo da mantenere la temperatura e la pressione di esercizio desiderate.
Considerazioni sulla camera di liofilizzazione
La scelta di un sistema di liofilizzazione: camera o rampa?
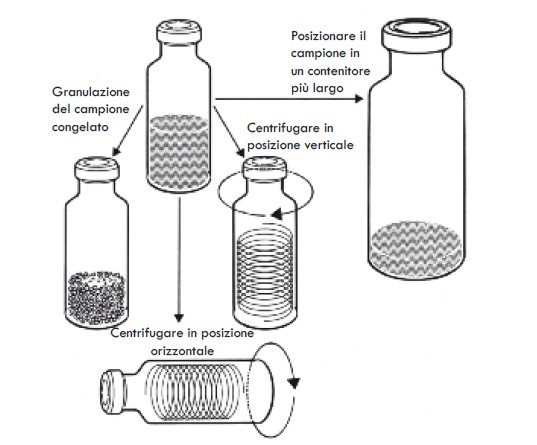
Mentre viene sottoposto a liofilizzazione, il campione è posizionato all’interno o su di un supporto per campione. Esistono molti tipi di supporti (come per esempio fiale, bottiglie, palloni di tutti i tipi, vassoi, ecc., cfr. Figura 1) e la scelta di quello da usare dipende molto dall’uso finale del prodotto.
I supporti per campioni sono generalmente posizionati in un alloggiamento a tenuta di vuoto chiamato camera di liofilizzazione. Quando viene usato il sistema di liofilizzazione a rampa, il contenitore in cui è posto il campione agisce come camera di liofilizzazione.
Nel decidere quale tipo di supporto per il campione è più adatto, dobbiamo prima domandarci “In che modo intendo adoperare il mio prodotto?”. I campioni che devono essere utilizzati in fiale, come per esempio medicinali o reagenti chimici, si dosano meglio in fiale in forma liquida e per essere poi nelle stesse liofilizzati. Questo metodo implica meno fasi di gestione riducendo i rischi di contaminazione e assicura dosaggi più riproducibili.
La dimensione della fiala richiesta dipende in parte dalla quantità del materiale in una dose. È regola generale che lo spessore del campione debba essere inferiore a 15-20 mm. Per la forma di una fiala, lo spazio libero all’interno di questa, ovvero lo spazio vuoto sopra il campione, è un’importante considerazione che limita il volume del campione adatto per una fiala. Per campioni di volume maggiore, è necessario spandere il campione sulle pareti della fiala (alterando la procedura di congelamento), o ricorrere alla liofilizzazione su vassoio.
Le fiale possono essere liofilizzate su un sistema a rampa, o disponendole su vassoi che vengono poi caricati “in massa” in una camera.
Un sistema a rampa è più semplice e più economico da usare quando si elaborano poche unità alla volta. In particolare, si risparmia il costo di una camera con la possibilità a volte di utilizzare una pompa a vuoto di minore capacità. Una rampa consente anche alle fiale di essere sigillate alla fiamma sotto vuoto.
Tuttavia, una volta che il numero delle unità di campione (sia che si tratti di fiale o palloni) diventa significativo, la gestione manuale con una rampa si complica notevolmente, e a quel punto è più vantaggioso l’impiego di un sistema a camera.
Un sistema a rampa può essere usato insieme con fiale più grandi o palloni. In questo caso, la fiala o il pallone agiscono da piccole camere di liofilizzazione.
I moderni contenitori di liofilizzazione hanno delle connessioni senza grasso (posizionate su guarnizioni di gomma) e sono disponibili sia in plastica (policarbonato) sia in vetro. Per campioni di particolato, il pallone di liofilizzazione del tipo a bocca larga è preferibile, essendo più facile inserire e rimuovere il campione, rispetto ai palloni standard da laboratorio dal collo conico e dalla base rotonda. Per i campioni liquidi, le preferenze tra palloni a bocca larga e a collo conico sono meno evidenti, essendo i modelli a bocca larga più facili da svuotare, mentre i modelli a collo conico sono più facili da usare con il congelamento superficiale rapido.
Con un sistema a rampa, è possibile, con cura, posizionare i campioni in modo indipendente sulla rampa o toglierli dalla rampa quando sono pronti; in questo modo, campioni di varie grandezze possono essere liofilizzati simultaneamente.
In alcuni casi, il sistema a rampa può essere anche utilizzato per la liofilizzazione di materiali diversi allo stesso tempo. Queste possibilità di maggiore flessibilità di gestione sono utili in un laboratorio chimico, quando la liofilizzazione riguarda una serie di piccoli lotti di campioni che fanno parte di una procedura di analisi.
Con un sistema a camera, i campioni vengono posizionati direttamente su scaffali o su vassoi estraibili. Se si è deciso di utilizzare dei vassoi, non è più necessario posizionare i campioni in fiale o bottiglie, poiché è possibile posizionare il campione direttamente sul vassoio (caricamento a vassoio). Il caricamento a vassoio possiede vantaggi e svantaggi. La quantità di campioni alloggiabili in un vassoio è superiore all’incirca del 40 % rispetto a quella effettivamente occupata in un vassoio di dimensione equivalente caricato a fiale o bottiglie, a causa dell’area del vassoio che si perde intorno alle fiale rotonde o alle bottiglie e a quella che si perde sulle pareti.
Il caricamento a vassoio causa inoltre un miglior contatto termico tra il campione e il vassoio, dando luogo ad una minor resistenza al trasferimento di calore.
I liquidi trattati in vassoio producono generalmente un liofilizzato di minore densità e minore porosità. Una bassa densità di materiale essiccato ha una scarsa economicità in termini di imballaggio, trattamento e conservazione (a causa dell’ampio volume per peso unitario) e quindi i campioni liquidi liofilizzati su vassoi vengono generalmente frantumati e macinati fino a diventare polvere per ottenere una maggiore densità di prodotto e una conseguente migliore convenienza.
Con il caricamento a vassoi, la sigillatura dei campioni in atmosfera gassosa speciale o sottovuoto non è generalmente possibile. Pertanto, mentre è possibile ottenere protezione esponendo il campione ad un gas inerte prima di aprire la camera, questo viene esposto alla fine all’aria al momento dell’estrazione dalla camera.
In alcuni casi, questo aspetto assume grande importanza rispetto alla successiva stabilità chimica nella conservazione. Usando degli speciali sistemi di stoppering, a fine liofilizzazione è possibile sigillare sotto vuoto o con gas inerte le fiale o le bottiglie caricate su vassoio in camere speciali.
Esiste una vasta gamma di camere progettate per ottenere uno o più obiettivi di liofilizzazione. Ad esempio, sono state progettate camere speciali per liofilizzare piccole sezioni di tessuto a bassa temperatura tramite l’impiego di sistemi esterni di raffreddamento. In camere del genere, vi sono dispositivi integrati che trattano ulteriormente il campione (crosslinking, inclusione, ecc.), e completano le fasi della liofilizzazione, per prepararlo all’analisi microscopica. La maggior parte delle camere, tuttavia, è più semplice, poiché i normali obiettivi di liofilizzazione non richiedono tali requisiti elevati.
Dopo aver presentato pro e contro dei sistemi a rampa e a camera è forse meglio concludere affermando che l’ideale sarebbe se il liofilizzatore fosse progettato in modo tale da essere impiegato per entrambi i sistemi. Questo è vero soprattutto se il liofilizzatore viene impiegato in ambiente di laboratorio, ottenendo in questo modo il massimo grado di flessibilità.
Parametri di liofilizzazione
La capacità di liofilizzazione in relazione a camera e campione: quanto prodotto dobbiamo liofilizzare al giorno?
Vi sono molti fattori legati al campione e alla camera (ad es., spessore del campione, riscaldamento della camera, ecc), che influenzano la quantità di prodotto che può essere liofilizzata in un dato periodo di tempo. Variando questi fattori si può controllare il processo di liofilizzazione; ma è proprio qui che si possono incontrare anche i maggiori problemi. Esaminiamo il modo in cui ognuno di questi fattori influenza il processo di liofilizzazione.
Spessore del campione – Lo spessore del campione influenza sia il tempo di liofilizzazione sia la quantità del materiale. Ovviamente, maggiore è lo spessore dello strato di materiale, maggiore è la quantità di campione che si può caricare nel liofilizzatore. Tuttavia, maggiore è lo spessore dei campioni, maggiore è il tempo impiegato per liofilizzare. Durante l’essiccazione, un campione molto spesso ha un alto spessore dello strato essiccato con un’elevata resistenza al trasferimento di calore e di materia.
Per trasmettere energia all’interfaccia attraverso uno strato essiccato alto e ad alta resistenza è necessaria una notevole differenza di temperatura (forza motrice) e poiché la maggior parte dei prodotti ha un limite superiore di temperatura legato alla qualità, è solitamente difficile mantenere la stessa velocità di essiccazione con un campione spesso, cosa invece possibile con un campione più sottile dello stesso materiale. Pertanto, in caso di campioni spessi, si deve accettare un rallentamento del processo di liofilizzazione.
Quindi, se la liofilizzazione deve essere completata entro un tempo ragionevole, si dovrebbe provare a seguire la regola del massimo spessore del campione (generalmente compreso tra 15-20 mm). In alcuni casi questo è impossibile (per esempio quando si liofilizza un animale intero) e in tal caso ci si deve aspettare una durata di liofilizzazione di giorni o settimane. Se si aumenta lo spessore del campione, si deve prendere in considerazione il conseguente aumento dell’acqua totale da caricare nel condensatore. È necessario essere sicuri che usando campioni molto spessi non si formi più acqua nella camera di quella che il condensatore è in grado di eliminare. Se il condensatore si sovraccarica, l’essiccazione non sarà mai completata.
Superficie del campione – Un altro metodo per aumentare la capacità del liofilizzatore è quello di incrementare la velocità di essiccazione (ovvero meno tempo necessario per l’essiccazione di una data quantità di materiale) in modo che la quantità di materiale da elaborare ogni giorno sia maggiore.
Sono molti i modi per raggiungere questi obiettivi. Uno fra questi consiste nell’aumentare la superficie del campione. Il trasferimento di calore al campione e il trasferimento dell’acqua fuori dal campione avvengono attraverso le superfici dello stesso: maggiore è la superficie del campione, maggiore è la velocità dell’estrazione d’acqua possibile.
È possibile aumentare la superficie in vari modi, ad es. rivestendo la parete del contenitore durante il congelamento (detto congelamento a centrifuga o congelamento superficiale) utilizzando dei contenitori di liofilizzazione più larghi, per granulazione o utilizzando più vassoi o contenitori (cfr. figura 14).
Se i contenitori di liofilizzazione vengono riempiti con una data quantità di campione liquido questo si deposita sul fondo del contenitore e, al momento del congelamento, ha un dato spessore.
Ne consegue che maggiore è il raggio del contenitore, maggiore è l’area che il liquido ricopre e minore è lo spessore dello strato del campione. La combinazione tra l’aumento dell’area di trasferimento e lo spessore ridotto produce un campione che si liofilizza più rapidamente.
Se durante la fase di congelamento il contenitore è inclinato in un angolo e viene ruotato, il liquido può essere distribuito sulla superficie delle pareti del contenitore, restituendo un campione con una maggiore superficie di trasferimento e uno spessore decisamente inferiore.
I metodi sopra descritti si applicano solo a materiali liquidi.
La granulazione (macinazione) del materiale congelato in piccoli pezzi (chiamati granuli) è applicabile sia ai liquidi che ai solidi. In questo modo si aumenta la superficie specifica del campione riducendo la dimensione pratica. La granulazione può essere simulata congelando il liquido in gocce, o spruzzandolo in un liquido immiscibile freddo, in un gas liquefatto o per separazione per urto su una piastra in metallo molto fredda.
Un ultimo metodo per aumentare la superficie del campione nel liofilizzatore è attaccare più contenitori di campione ad una rampa del liofilizzatore, o disporre più vassoi in una camera di liofilizzazione. In questo modo si ottiene un aumento della superficie senza diminuire lo spessore del campione.
Vi è ancora una possibilità che la quantità del carico d’acqua posizionata nella liofilizzazione sia maggiore di quella che il condensatore può sopportare, il che (come osservato in precedenza) può provocare il mancato completamento del processo di liofilizzazione.
Quando si tenta di aumentare la velocità di liofilizzazione, come osservato in precedenza, c’è il rischio di perdita di qualità del prodotto se la velocità alla quale l’acqua viene trasportata dal campione al condensatore diviene troppo elevata da richiedere un’importante caduta di pressione per superare le resistenze del trasferimento di materia nelle valvole o nei tubi della rampa o della camera. Ad esempio, maggiore è la superficie di campione disposta su una rampa, maggiore è la quantità di acqua per unità tempo che deve essere spostata dal campione al condensatore.
Quando il condensatore ha una capacità di rimozione di calore adeguata per condensare tutta l’acqua in arrivo, la differenza di pressione necessaria (forza motrice) per il trasferimento della materia si ottiene aumentando la pressione dell’acqua nel campione che a sua volta provoca un aumento di temperatura nel campione, dando luogo a cambiamenti strutturali a seconda della proprietà del materiale. Poiché la velocità di trasporto dell’acqua al condensatore aumenta, a sua volta anche la temperatura del condensatore inizierà ad aumentare, poiché la capacità di rimozione del calore del condensatore diviene inadeguata rispetto alla velocità di trasmissione del vapore.
Per mantenere la portata di trasporto d’acqua necessaria, si deve aumentare ulteriormente la pressione del vapore acqueo del campione in modo che venga mantenuta la differenza di pressione dell’acqua tra il campione e il condensatore.
Sulla base dello stesso ragionamento illustrato in precedenza, gli aumenti di pressione dell’acqua nel campione (e di conseguenza della temperatura nel campione) causano un ulteriore potenziale deterioramento della struttura.
Per riassumere questa situazione, è fondamentale che la quantità d’acqua da trasportare nei tubi e nelle valvole del liofilizzatore venga pianificata secondo la capacità di trasporto di queste unità, prendendo in considerazione la capacità del condensatore e le proprietà del materiale da liofilizzare.
Possiamo dire che esiste un massimo per la quantità di campione e di superficie di campione che può essere posizionata sui vassoi, in camera o nei contenitori su una rampa. Questi limiti massimi sono flessibili poiché i materiali che sono di per sé più strutturalmente stabili sono in grado di tollerare carichi maggiori rispetto a materiali più sensibili. Un altro fattore che rientra in queste considerazioni è il riscaldamento del campione, che verrà esaminato qui di seguito.
Riscaldamento del campione – In precedenza abbiamo visto che per sublimare il ghiaccio e desorbire l’acqua legata (ovvero per eseguire le ultime due fasi del processo di liofilizzazione) è necessario fornire energia al campione. Anche quando non eseguiamo alcuno sforzo consapevole per fornire energia durante la liofilizzazione, la natura in realtà si sta assicurando che venga trasferita la quantità di energia necessaria.
In Figura 15 si vede che posizionando un campione in un pallone disposto su una rampa, viene fornito calore dall’aria della stanza all’esterno del pallone alla parete più fredda dello stesso per mezzo del processo di convezione.
Il calore è trasferito per conduzione attraverso la parete del pallone verso il campione e successivamente dopo aver attraversato l’interfaccia tra la parete del pallone e lo strato congelato viene condotto fino all’interfaccia nel campione dove si incontrano lo strato congelato e lo strato essiccato. Sull’interfaccia, l’energia viene usata per sublimare alcuni cristalli di ghiaccio in modo tale che il prodotto si essicchi ancora.
Per i campioni su un vassoio in una camera di essiccazione, il percorso seguito dal trasferimento di calore è leggermente differente, ma in effetti si nota che anche se non ci si preoccupa in alcun modo di fornire calore, è la natura a farsene carico.
Ora, si è visto che il calore è necessario per liofilizzare e che viene fornito dalla natura (se non lo facciamo noi), e possiamo subito notare che la velocità alla quale il calore viene fornito dalla natura è alquanto arbitraria ed è probabilmente troppo veloce o troppo lenta.
Come abbiamo osservato in precedenza, sono le proprietà del campione a determinare il grado di tollerabilità della velocità del trasferimento. Pertanto, se il campione è sensibile ai cambiamenti strutturali, il trasferimento di calore naturale potrebbe essere troppo veloce, mentre se è relativamente insensibile, la velocità naturale è troppo lenta.
Nella maggior parte dei casi, la velocità naturale è lenta abbastanza affinché la liofilizzazione avvenga secondo quello che è definito “riscaldamento non esterno”.
Tornando al problema della capacità del liofilizzatore, maggiore è la velocità con la quale si rimuovere l’acqua dal campione, minore è il tempo necessario nella camera di essiccazione per unità, e pertanto potranno essere lavorate più unità in un dato periodo.
Nella maggior parte dei casi, la velocità di trasferimento di calore dalla natura al campione è inferiore a quella che il prodotto può tollerare e di conseguenza l’essiccazione procede più lentamente rispetto al limite massimo.
Il modo più semplice per aumentare la capacità del liofilizzatore è incrementare la velocità del trasferimento di calore al campione per mezzo di un riscaldamento artificiale, regolabile. Con la presenza di riscaldatori artificiali, regolabili, si può regolare la velocità di trasferimento di calore al campione in base alla sua sensibilità ai cambiamenti fisici o chimici.
L’aumento della velocità del trasferimento di calore al campione per mezzo di un riscaldamento con temperature al di sopra di quella ambiente è il metodo più impiegato per aumentare la velocità di liofilizzazione e di conseguenza la capacità del liofilizzatore.
Come osservato in precedenza, ogni metodo per aumentare la capacità del liofilizzatore ha dei limiti di incremento, e questa osservazione è vera in particolare per il riscaldamento del campione.
Abbiamo visto che il campione ha dei limiti di temperatura che non devono essere superati in relazione alla perdita della stabilità strutturale o alle alterazioni chimiche.
Come già osservato nelle sezioni sulla relazione tra capacità, spessore del campione e superficie del campione, l’aumento della velocità del trasporto di acqua - incrementando la velocità del trasferimento di calore al campione - può dar luogo ad un sovraccarico dei percorsi di trasferimento della materia (per esempio il sistema di tubi e valvole di una rampa). Questo provoca un aumento della pressione dell’acqua nel campione, necessaria affinché la differenza di pressione per il trasferimento della materia sia ampia abbastanza per eliminare la necessaria quantità d’acqua.
L’aumento di pressione nel campione provoca un conseguente aumento di temperatura, e se può diventare abbastanza elevato (per es., tramite un aumento continuo della velocità di trasferimento del calore), la temperatura di stabilità del campione viene superata e il campione diventa soggetto a cambiamenti strutturali, le cui conseguenze sono già state esaminate.
Osservando con attenzione il campione in una scala più microscopica, si nota che se si considera la situazione all’interfaccia (velocità del trasferimento di calore e acqua da e verso l’interfaccia) le resistenze al trasferimento di materia dello strato essiccato sono importanti per determinare la stabilità strutturale della regione dell’interfaccia e quindi la velocità consentita (o massima) del trasferimento di calore. Pertanto, è essenziale considerare sia le situazioni di trasferimento di calore e di materia “microscopiche”, sia quelle “macroscopiche”.
I metodi e i problemi associati ad un riscaldamento artificiale e controllabile del campione dipendono in qualche modo dalla relazione del campione con il mezzo di riscaldamento.
In generale esistono tre tipi di relazioni: una per il riscaldamento dei campioni sulle rampe e due per il riscaldamento dei campioni su vassoi nella camera di liofilizzazione. Il riscaldamento dei campioni su una rampa è stato descritto come una combinazione di convezione e conduzione (Figura 15).
Possiamo aumentare la velocità di trasferimento del calore al contenitore sulla rampa riscaldando l’aria, soffiando l’aria più velocemente sulla superficie esterna del contenitore, rimuovendo qualsiasi strato di ghiaccio condensato (questo strato di ghiaccio oppone resistenza al trasferimento di calore), oppure sottoponendo il pallone ad una fonte di calore radiante.
Se il contatto tra campione e parete interna del pallone non è buono (per es., a causa della rottura del campione), la velocità di trasferimento del calore si abbassa e il tempo di essiccazione si allunga.
L’uso di una fonte di calore radiante, come ad es. una lampada da riscaldamento, può migliorare la velocità di essiccazione poiché può trasferire il calore direttamente alla superficie del campione. Ma un tale trasferimento di calore diretto può essere pericoloso e causare il surriscaldamento, se non controllato con cura.
La situazione per i campioni su vassoio nella camera di essiccazione dipende dal contatto diretto (e buono) dei vassoi con la fonte di riscaldamento, o dalla sospensione dei vassoi tra la fonti di calore senza contatto diretto (cfr. Fig. 15).
Nel primo caso, il campione viene riscaldato principalmente per conduzione dalla fonte di calore, tramite i vari strati del vassoio, supporto del campione e strato congelato del campione. In realtà è simile al caso dei palloni sulla rampa eccetto che a causa del vuoto nella camera di liofilizzazione la convezione non è importante come il trasferimento di calore. Ciò significa che se il contatto tra la piastra di riscaldamento e le superfici del supporto del campione non è buono, non lo è neppure il trasferimento di calore per conduzione e la velocità di essiccazione diminuisce notevolmente.
Questo è particolarmente importante in caso di contatto tra vassoi ed elementi riscaldanti (i vassoio spesso si deformano se maneggiati bruscamente) o fiale /palloni e vassoi (la maggior parte delle fiale ha un fondo leggermente concavo). Un eventuale controllo di trasferimento di calore deve considerare queste situazioni non ideali.
La seconda modalità di trasferimento del calore per l’essiccazione di campioni su vassoi in camera di liofilizzazione avviene tramite riscaldamento radiante del campione e della superficie del vassoio. Per avere una velocità ragionevole di trasferimento di calore sono necessarie temperature molto più elevate rispetto a quelle dei sistemi di riscaldamento a conduzione.
Il riscaldamento radiante presenta i suoi vantaggi (tende ad essere più omogeneo attraverso i vassoi, nonché meno sensibile al cattivo uso dei vassoi), e svantaggi (richiede maggiore energia a causa delle dispersioni di calore dalla camera del liofilizzatore associate alle temperature più alte). Inoltre, poiché di solito si fornisce calore radiante da due lati, parte del trasferimento di calore passa tramite lo strato essiccato. Poiché quest’ultimo ha un’elevata resistenza al trasferimento di calore, è necessario usare delle temperature alquanto elevate sulla superficie del campione per ottenere un ragionevole trasferimento termico all’interfaccia. Ciò comporta il rischio di danni da riscaldamento al campione essiccato dovuti ad un surriscaldamento.
Pertanto, con il riscaldamento radiante, bisogna prendere in considerazione un’altra condizione: il surriscaldamento dello strato essiccato con conseguenti danni chimici o strutturali.
Riscaldare o non riscaldare, e come? questo è il problema
La scelta del (tipo di) riscaldamento dipende molto dalla resa richiesta al liofilizzatore e dalla sensibilità del campione.
Il prodotto ottenuto non è sicuramente migliore quando si usa il riscaldamento, ma allo stesso tempo, ci sono delle velocità di riscaldamento alle quali la qualità non viene cambiata dal calore. A velocità di riscaldamento superiori ai limiti, la qualità si abbassa, sebbene quanto “rapidamente “dipende dai fattori ritenuti più importanti per determinare il valore del prodotto (p. es. mantenimento dell’attività enzimatica vs. velocità di solubilità).
Se il tasso di resa è adeguato è sufficiente il calore naturale. D’altro canto, se l’esperienza mostra che la capacità del liofilizzatore di utilizzare calore naturale è inadeguata rispetto alla quantità di materiale da liofilizzare, si potrebbe vagliare la possibilità di ottenere migliori velocità di essiccazione incrementando la superficie del campione o diminuendone lo spessore, avendo cura tuttavia di non superare i limiti di sovraccarico già visti.
Se sono richiesti ulteriori aumenti della capacità, non vi è molta alternativa all’uso di riscaldamento artificiale per accelerare il processo di essiccazione. Ancora, i limiti visti in precedenza devono essere rispettati per mantenere la qualità del prodotto.
Il metodo di riscaldamento dipende in parte dal tipo di sistema coinvolto. Per un sistema a rampa, il riscaldamento può avvenire per mezzo di generatori di aria calda, resistenza elettrica o lampade da riscaldamento, o per mezzo di dispositivi speciali che consentono l’uso di un liquido di circolazione da un bagno riscaldato. In quest’ultimo caso, il contenitore per la liofilizzazione potrebbe avere un rivestimento integrato o la rampa e i contenitori potrebbero essere disposti in modo tale che questi ultimi possano essere immersi una vasca aperta tramite la quale circola il liquido.
In generale, il riscaldamento con liquido di circolazione per un’unità di liofilizzazione a rampa è scomodo se vi sono pochi contenitori sulla rampa.
In un liofilizzatore a camera, il riscaldamento si esegue generalmente facendo circolare un liquido pre-riscaldato attraverso delle piastre concave di riscaldamento da un serbatoio di un sistema a ciclo chiuso o per mezzo di unità elettriche di riscaldamento (come ad esempio riscaldatori di gomma di silicone) legati alle piastre di riscaldamento.
Le unità di riscaldamento elettriche sono più economiche per piccolo sistemi di liofilizzazione da laboratorio, mentre il sistema a circolazione di liquido è più adatto ad impianti più grandi. Con il liquido di circolazione, è possibile riscaldare e raffreddare affinché il controllo della temperatura vada in una delle due direzioni.
Dall’altro lato, la costante tempo per un sistema a liquido di circolazione è generalmente maggiore rispetto al sistema di riscaldamento elettrico, rendendo il controllo meno reattivo.
Quando tutti i fattori sono stati presi in considerazione, la soluzione finale sembra essere una combinazione di entrambi i sistemi. Eppure, un sistema a circolazione di liquido con entrambe le funzioni di riscaldamento e di raffreddamento sarebbe preferibile in generale nel momento in cui si procede con l’essiccazione di materiali sensibili al calore, essendo in questo modo il controllo della temperatura più preciso.
Supplemento A: Proprietà dell'acqua
I grafici dell’equilibrio di fase per l’acqua e le soluzioni acquose mostrano i vari stati in cui l’acqua può esistere in determinate condizioni di temperatura (T), pressione (P) e composizione (X). Per stati si intende la condizione fisica dell’acqua, per esempio acqua allo stato solido (ghiaccio), acqua allo stato liquido e acqua allo stato gassoso (vapore acqueo). La base per la rappresentazione degli stati in termini di temperatura, pressione e composizione ha origine da questi parametri alquanto controllabili. In ultimo, per equilibrio si intende, in caso di una non modificazione delle condizioni ambientali (T, P o X), l’invariabilità dello/gli stato/i presenti.
Poiché vi sono tre variabili controllabili (T, P, X), il grafico della fase per l’acqua esiste come grafico in 3-dimensioni, con gli assi T, P e X. Il grafico tridimensionale è alquanto complesso, ed è generalmente impiegato per esaminare le proprietà dell’acqua in una serie di grafici bidimensionali. I due di maggiore interesse per la liofilizzazione sono la relazione pressione-temperatura per l’acqua pura (chiamato grafico P-T a X=0) e il grafico temperatura-composizione a pressione atmosferica (grafico T-X a P = I atm).
Il grafico pressione-temperatura
Prima di tutto parliamo delle unità di pressione. Molta della letteratura sulla liofilizzazione fino ai tempi più recenti utilizzava le unità “mm Hg” o “torr” (equivalenti), sebbene di recente vi sia stata una tendenza in aumento all’uso delle unità SI Pascal (Pa) e millibar (mbar). Molti dei diagrammi di fase usano le atmosfere (atm) come unità di pressione. La relazione tra queste unità è I atm = 760 torr = 760 mm Hg = 1013 mbar = 101300 Pa.
Dal grafico P-T si ottengono molte informazioni. Gli assi denotano la pressione esercitata dalle molecole dell’acqua e la temperatura di queste molecole d’acqua. Vi sono regioni di stati (definite solido, gassoso e liquido) legate dalle linee AB, BC e BD, che creano le combinazioni di temperature e pressione alle quali l’acqua, che si trova in uno stato, passa all’altro, ovvero le condizioni di coesistenza di due stati.
Alcuni di questi punti punti sono ben noti; ad esempio il punto E si trova a +100°C e 1013 mbar (pressione atmosferica). Sappiamo che a +100°C possiamo convertire l’acqua liquida in vapore, un processo chiamato ebollizione, a 1 atmosfera di pressione. Nell’ “ebollizione” vediamo che le molecole d’acqua esercitano una pressione di 1 atm, bilanciando la pressione totale dell’aria.
Se vivessimo in cima al monte Everest, dove la pressione atmosferica è solo di 0,31 atm (la pressione scende con l’aumentare dell’altitudine), l’acqua bollirebbe a +71°C (mostrato nel punto G). Si noti che anche se non sono +100°C, si assiste ad un passaggio da liquido a vapore acqueo.
Utilizziamo questa informazione (abbassando la pressione affinché l’acqua bolla a basse temperature, come al punto H) quando usiamo un evaporatore a vuoto per convertire l’acqua liquida in vapore a temperature miti. La linea BD denota il passaggio di stato tra l’acqua liquida e il vapore acqueo. La formazione di vapore acqueo dall’acqua liquida si chiama processo di evaporazione mentre il processo inverso è chiamato condensazione.
Ad eccezione di circostanze speciali, questa linea termina a 0°C, una temperatura a noi familiare. Il punto B si trova all’intersezione delle tre regioni e come tale ha un’importanza speciale e un nome, il punto triplo dell’acqua (è in realtà +0,01°C, ma qui diremo che è 0°C).
Se osserviamo la linea C, notiamo che è quasi verticale, il che significa che le transizioni tra acqua solida e acqua liquida (cristallizzazione o congelamento e scioglimento) si verificano a 0°C, essenzialmente indipendenti dalla pressione di vapore dell’acqua.
L’ultima linea, AB, che separa l’acqua solida e le regioni di vapore acqueo, è probabilmente meno conosciuta rispetto alle prime due linee, il che è un peccato, poiché è qui che avviene la liofilizzazione.
La linea AB presenta le pressioni corrispondenti e le temperature alle quali l’acqua solida viene convertita direttamente in vapore acqueo (chiamata sublimazione), o da vapore acqueo viene convertita in acqua allo stato solido (chiamata condensazione). In queste regioni, non vi sono liquidi compresi nel passaggio.
Proprio come noi riusciamo a ricordare il valore standard per la temperatura di ebollizione nella nostra mente (+100°C = 1 atm), le persone che lavorano con la liofilizzazione ricordano valori specifici di loro interesse.
Pertanto, se abbiamo del ghiaccio a 0°C, esso esercita una pressione di 4,6 torr (punto B); per contro, se possiamo mantenere la pressione del vapore acqueo sul ghiaccio a circa 1,33 mbar, allora il ghiaccio ha una temperatura di circa -20°C (punto J).
Se scendiamo ancora, a -40°C, il ghiaccio esercita una pressione ancora minore di circa 0,133 mbar (punto K). Il “trucco” per la liofilizzazione è quello di usare queste differenze di pressione per rimuovere l’acqua dal nostro prodotto.
Questo processo viene esaminato nel capitolo 9 del testo principale e nel Supplemento C.
Per riassumere, abbiamo visto che l’acqua può passare dai suoi tre stati e che i cambiamenti che si verificano dipendono o dalla pressione dell’acqua o dalla temperatura, variabili controllabili. Si noti che queste conversioni (chiamate transizioni di fase) si verificano solo con la trasmissione o la sottrazione di energia alle molecole dell’acqua.
Il grafico composizione-temperatura
Il grafico X-T viene usato per mostrare l’influenza di soluti aggiunti sul comportamento dell’acqua della transizione di fase. Per semplicità, verranno mostrati solo i cambiamenti solido-liquido (per una soluzione ideale). Ad una temperatura maggiore, troveremo la linea corrispondente liquido vapore. (Alla pressione scelta, non vi è una linea solido-vapore.)
Quando si esamina la liofilizzazione, è più facile presentare grafici separati X-T per i due comportamenti di transizione solido-liquido incontrati. Un tipo di comportamento X-T, caratteristico per sali come ad esempio i tamponi, viene definito eutectic forming (Figura A 2), mentre l’altro, caratteristico degli zuccheri e per una serie di altri materiali biologici, viene definito glass-forming (Figura A 3).
Vi sono molte similitudini tra i grafici, il che semplifica la loro analisi. Vi sono due linee principali di transizione di fase (AB o ADB e BC o CD) per i due componenti del sistema, acqua e soluto. Inoltre, il grafico eutectic-forming ha una linea DBE, che definisce la temperatura più bassa, la temperatura eutettica, alla quale il liquido può esistere in un tale sistema. L’assenza di questa linea nel grafico glass-forming indica che in teoria non vi è alcuna temperatura alla quale il liquido non esiste.
È importante notare la parola “in teoria”, tuttavia, poiché ad una temperatura sufficientemente bassa (sotto la temperatura di transizione vetrosa) il prodotto si comporta come un solido. Tuttavia, il prodotto è in realtà un liquido molto viscoso anche se assomiglia ad un solido, e raffreddandosi sotto la temperatura di transizione vetrosa non dà luogo ad una transizione reale liquido-solido.
Possiamo vedere da questi grafici a due componenti (acqua e soluto) che l’asse della composizione è l’”immagine speculare” di ciascun componente (ovvero 100% acqua significa 0% soluto, ecc). Pertanto, la temperatura della transizione di fase del soluto 0% è la temperatura di cristallizzazione (congelamento)/ scioglimento dell’acqua pura (0°C) come analizzato nel grafico P-T. Questo punto viene mostrato nelle Figure A 2 e A 3 come Tm. Analogamente, se abbiamo un soluto puro (100% soluto), la temperatura di cristallizzazione/ scioglimento viene mostrata come Tc.
Aggiungendo un soluto all’acqua o dell’acqua al soluto, la temperatura di congelamento o di cristallizzazione (ovvero la temperatura alla quale il solido e il liquido cambiano stato) diminuisce.
Il lato dell’acqua (linea AB – di maggiore interesse per la liofilizzazione) descrive ciò che accade non appena si raffredda una soluzione che inizialmente è ad una temperatura T e composizione Xs.
Per evitare di complicare la discussione, si presume che il sistema sia sempre in equilibrio; nella vita reale possiamo avere condizioni di disequilibrio come per esempio sub-raffreddamento o sovra-raffreddamento, che generano comportamenti più complessi.
Inizialmente, il raffreddamento della soluzione abbassa la temperatura senza modificarne la composizione. Si rimane nella regione del liquido fino a che la temperatura non scende a Tfs, che rappresenta la temperatura di congelamento corrispondente a Xs, illustrato nelle Figure A 2 e A 3 dalla linea SR.
Quando la soluzione raggiunge la temperatura Tfs, un raffreddamento continuo provoca il superamento da parte del sistema della linea di confine della fase e si formano i primi cristalli di ghiaccio. I cristalli di ghiaccio sono la forma delle molecole d’acqua a struttura solida e sono puri (ovvero 100% d’acqua). Con questa cristallizzazione di alcune delle molecole d’acqua, vi sono ora poche molecole d’acqua liquida rimaste nella soluzione e pertanto la composizione cambia nella direzione di un percentuale più alta di soluto.
Continuando ad abbassare la linea SR al punto U si entra nella regione di fase liquido più acqua solida. Al punto U, abbiamo un mix di cristalli di ghiaccio (X=0) e una soluzione più concentrata (X=Xp) alla temperatura Tfp. Se ora consideriamo una seconda soluzione ad una temperatura T di una concentrazione iniziale più elevata di soluto Xp, possiamo vedere che è necessario raffreddare questa soluzione a Tfp prima che si formino i primi cristalli di ghiaccio. A questo punto, la soluzione non congelata da S e P agisce in maniera identica nel momento in cui la temperatura viene abbassata ulteriormente.
La differenza maggiore tra queste due soluzioni è la percentuale della soluzione iniziale presente sotto forma di ghiaccio. Più è concentrata la soluzione iniziale, minore è la presenza di ghiaccio a qualsiasi temperatura. Tornando ora alla soluzione S, un ulteriore raffreddamento porta al punto in cui si distingue tra soluti eutectic-forming e glass-forming.
Per eutectic-former, esiste una combinazione unica di temperatura e composizione (chiamata temperatura eutettica e composizione eutettica) alla quale l’acqua e il soluto insieme formano una fase solida mischiata chiamata eutettica.
Raffreddando il campione alla temperatura eutettica, avviene questa transizione di fase e raffreddandolo ulteriormente al di sotto della temperatura eutettica non si ottengono ulteriori concentrazioni di campione poiché questo risulta completamente solidificato.
Quando si congelano soluzioni glass-forming, la fase liquida diventa sempre più concentrata. Alla fine non è possibile rimuovere altra acqua dalla fase liquida formando cristalli di ghiaccio dato che il materiale è diventato rigido a causa della bassa temperatura e all’elevato contenuto di soluto.
Diciamo che il campione è “solido”, ma in realtà si tratta di un liquido molto rigido e viscoso. Mentre questa apparenza “solida” non è una condizione stabile, la velocità alla quale questo “liquido” scorre è generalmente talmente bassa da non poter notare lo scorrimento del liquido in un periodo di tempo ragionevole. La velocità del flusso è, tuttavia, molto sensibile ai cambiamenti di temperatura e il “solido” ritorna ad un’ovvia condizione di liquido in un limitato range di temperatura.
In breve, abbiamo visto come il raffreddamento di una soluzione porti alla formazione di acqua solida (ghiaccio) e alla concentrazione della fase liquida restante. Maggiore è la concentrazione della soluzione iniziale, minore è il ghiaccio che si forma ad una data temperatura di congelamento.
Infine, abbiamo due tipi base di soluzioni, eutectic former o glass former; la genera una totale fase solida a temperature alquanto basse, mentre la seconda produce un liquido altamente concentrato e viscoso, conosciuto come vetro. Queste differenze sono importanti per il comportamento della liofilizzazione.
Supplemento B: Proprietà dei materiali
Abbiamo visto che alcuni fattori generali, definiti fattori di stabilità, sono importanti per ottenere liofilizzati di alta qualità. Le proprietà del materiale relative a questi fattori influenzano la “liofilizzabilità del materiale”, in particolare i limiti ai quali il processo di liofilizzazione deve avvenire. Questi fattori di stabilità si dividono in due gruppi principali: (1) stabilità strutturale e (2) stabilità chimica.
Stabilità strutturale dei materiali
La stabilità strutturale di un materiale si riferisce alla propria capacità di essere sottoposto al processo di liofilizzazione senza subire cambiamenti di dimensione e forma. Una scarsa stabilità strutturale produce generalmente a prodotti rinsecchiti o gonfi, dall’aspetto vitreo e spesso appiccicosi.
Relativamente alla stabilità strutturale, i soluti eutectic-forming e glass-forming mostrano comportamenti diversi. L’alterazione della struttura per gli eutectic-forming comprende lo scioglimento e la dissoluzione, mentre i glass-forming comprendono cambiamenti relativi alla “rigidità” del materiale.
Scioglimento / dissoluzione e struttura (soluti eutectic-forming)
Abbiamo visto in precedenza (Supplemento A) che alla temperatura eutettica la soluzione eutettica non congelata solidifica come sistema misto di cristalli di ghiaccio e cristalli soluti. Pertanto, a temperature inferiori alla temperatura eutettica, il campione è completamente solido, essendo solamente composto da molecole cristalline. Con l’aumentare della temperatura di un eutettico solidificato si verifica un cambiamento importante nella struttura quando la temperatura eutettica viene raggiunta, poiché l’intero eutettico solidificato si scioglie ad una singola temperatura.
Un ulteriore aumento della temperatura provoca lo scioglimento di parte del ghiaccio residuo in modo tale che la concentrazione della soluzione diminuisce a seconda della curva del punto di congelamento. Poiché molti soluti eutectic-forming sono materiali a basso peso molecolare, l’eutettico sciolto ha una capacità di stabilizzazione strutturale molto ridotta.
I cristalli di ghiaccio stessi agiscono da supporto alla struttura per il materiale congelato e quindi la stabilità generale di un campione eutectic-forming in cui l’eutettico si è sciolto dipende parzialmente dalla concentrazione iniziale della soluzione e dalla concentrazione eutettica. Ciò determina la proporzione del campione iniziale presente sotto forma di cristalli di ghiaccio alla concentrazione e alla temperatura eutettica. Un materiale con una concentrazione eutettica elevata ed una bassa concentrazione solida iniziale converte gran parte dell’acqua in ghiaccio prima di raggiungere la concentrazione eutettica. Ad un analisi macroscopica tale campione potrebbe apparire strutturalmente stabile anche se l’eutettico potrebbe essere sciolto.
Il collasso strutturale del materiale (a base eutettica) si verifica tramite lo scioglimento della struttura cristallina (se la temperatura aumenta ad una quantità d’acqua costante) o tramite dissoluzione (se la quantità d’acqua viene aumentata ad una temperatura costante). L’acqua deve essere aggiunta fino ad ottenere una soluzione satura prima che la struttura cambi.
“Rigidità” e struttura (soluti glass-forming)
Il concetto di rigidità viene impiegato per descrivere le proprietà fisiche reologiche che caratterizzano il comportamento della stabilità strutturale di un materiale glass-forming. La rigidità è una misura di resistenza di un materiale all’azione delle forze esterne che agiscono per cambiarne la forma. (La rigidità è legata alla viscosità nei liquidi, o agli elementi viscoelastici in un solido.)
Per avere una struttura stabile quando si liofilizza un soluto glass-forming il campione deve avere una rigidità adeguata per tutto il processo. Vi sono tre fattori principali che influenzano la rigidità: composizione molecolare, temperatura del campione e contenuto di umidità nel campione. Poiché l’instabilità strutturale coinvolge una deformazione iniziale o nel tempo, si tratta di una proprietà dipendente dal tempo.
Ciò significa che si definisce strutturalmente stabile un materiale se la deformazione in un dato periodo di tempo è minore di quella che si riesce a misurare. Forse, se osservassimo più a lungo, noteremmo il cambiamento e pertanto definiremmo il materiale instabile. Così, la stabilità dipende anche dal tempo dedicato all’osservazione.
Per la liofilizzazione si stabilisce generalmente che il tempo di osservazione equivale alla durata del processo di liofilizzazione.
Influenza della temperatura e dell’umidità sulla rigidità
L’influenza della temperatura e dell’umidità sulla stabilità del campione per un materiale singolo (ovvero composizione molecolare fissa) viene mostrata in Figura B 1. Esiste un’interazione tra il contenuto di umidità e la temperatura che determina il confine della stabilità del campione (ovvero il confine tra campioni stabili e instabili). Se riduciamo il contenuto di umidità di un campione, questo sarà stabile ad una temperatura più elevata (per lo stesso tempo di osservazione) o viceversa.
Figura B 1 mostra anche l’effetto del cambiamento del tempo di osservazione sulla relazione temperatura-contenuto di umidità per il confine di stabilità (qui T1 è minore di T2). Per mantenere la struttura durante il processo di liofilizzazione, è necessario che il materiale resti sempre nella regione di stabilità. Ciò significa che per ogni contenuto di umidità esistente nel campione durante l’essiccazione, esiste una temperatura critica (spesso chiamata “temperatura di collasso” nella letteratura scientifica) sopra la quale quella regione del campione non è ammessa se deve essere assicurata la stabilità strutturale.
Dalla forma generale del confine di stabilità in Figura B 1, possiamo vedere che la temperatura di collasso è massima per un contenuto di umidità pari a zero e diminuisce con l’aumentare del contenuto di umidità fino a raggiungere un intervallo di contenuto di umidità sopra il quale la temperatura di collasso non aumenta ulteriormente.
La regione con umidità 0- 5% è di maggiore interesse nel considerare la stabilità del prodotto finale liofilizzato, mentre l’altra estremità della scala del contenuto di umidità (fino a 25- 30% di umidità e oltre) risulta di maggiore interesse per il processo di liofilizzazione stesso.
Figura B 1. Influenza della temperatura e del contenuto di umidità sul limite della stabilità strutturale di un materiale.

Con un contenuto di umidità più elevato la temperatura di collasso non diminuisce nemmeno aumentando il contenuto dell’umidità; ciò è dovuto al comportamento speciale dell’acqua nel sistema di liofilizzazione.
Nel momento in cui abbassiamo la temperatura sotto lo 0°C, una porzione dell’acqua liquida viene convertita in acqua solida (ghiaccio).
Pertanto, mentre la media totale del contenuto di umidità del campione resta invariata (poiché acqua liquida e acqua allo stato solido sono conteggiate nella media totale), l’umidità liquida associata ai solidi è alquanto inferiore ed è solo questa umidità liquida associata ai solidi che risulta importante nella determinazione del comportamento del flusso o di deformazione del materiale.
Come abbiamo visto in precedenza esaminando il grafico X-T (Supplemento A) durante il processo di congelamento, abbiamo infine raggiunto un contenuto di umidità associato ai solidi in cui l’ulteriore eliminazione dell’acqua liquida viene ostacolata dall’aumento della rigidità del campione. Pertanto, a livelli medi di umidità maggiori di questa concentrazione associata al solido, la temperatura di collasso resta costante.
Per i sistemi di soluti glass-forming, la presenza di ghiaccio ha un’influenza significativa sulla stabilità strutturale del campione.
Abbiamo notato in precedenza per i glass-former (Supplemento A) che (1) quando congeliamo una soluzione, otteniamo una miscela di ghiaccio e una soluzione più concentrata e (2) la quantità di ghiaccio formata ad una data temperatura diminuisce con l’aumentare della concentrazione della soluzione iniziale.
La stabilità strutturale generale del campione dipende dalla sua rigidità generale, che comprende la rigidità della fase del ghiaccio e la rigidità della fase del soluto concentrato. I cristalli di ghiaccio puro sono alquanto rigidi anche a 0°C, così la fase di ghiaccio presente in un campione costituisce un contributo importante alla rigidità complessiva del campione.
Esaminando l’influenza della temperatura e dell’umidità sulla rigidità di un campione contenente sia fasi di ghiaccio sia di materiale, si nota dalla Figura A 3 che se aumentiamo leggermente la temperatura del campione congelato si verificano due azioni: la conversione di acqua solida (ghiaccio) in acqua liquida associata al soluto (ovvero un aumento del contenuto vero e proprio di umidità del materiale solido anche se il contenuto generale del campione è invariato) e l’aumento della temperatura nel campione.
Figura B 3. Relazione tra il peso molecolare del materiale e la temperatura massima che fornisce stabilità strutturale per un dato contenuto di umidità del campione.

Poiché ognuna di queste azioni dà luogo ad una diminuzione della rigidità del campione, i campioni congelati con ghiaccio sono molto più sensibili ad un aumento di temperatura rispetto a campioni in cui il ghiaccio non è presente. Ciò significa che il materiale congelato può essere particolarmente sensibile ad una perdita di struttura durante la liofilizzazione.
Composizione molecolare e rigidità
Ogni materiale ha la propria curva temperatura-contenuto di umidità che ne definisce il limite della stabilità strutturale.
Figura B2 fornisce una serie di curve per 3 membri di una famiglia di composti. Esempi potrebbero essere i saccaridi a base di glucosio (glucosio, maltosio, maltotriosio ... maltodestrine (idrolizzati di amido) ... amido) o i polimeri di amminoacidi (amminoacidi, dipeptidi, ... polipeptidi, ... proteine).
Minore è il peso molecolare del materiale, più bassa è la curva del limite di stabilità. Ciò significa che ad ogni contenuto di umidità, minore è il peso molecolare, minore è la temperatura alla quale avviene il collasso strutturale. Aumentando il peso molecolare del campione si raggiunge il mantenimento della stabilità a temperature più elevate.
Figura B 3 mostra che i dati della Figura B 2 possono essere presentati come una relazione diretta (qui per il contenuto di umidità Ma). Il fatto che 1/MW sia lineare con la temperatura di collasso significa che l'effetto del peso molecolare viene notato principalmente a pesi molecolari bassi (ovvero 1/MW è alto), e che quando abbiamo due composti di peso molecolare molto superiore un ulteriore aumento del peso molecolare ha un effetto supplementare sulla temperatura di collasso.
Stabilità chimica dei materiali
La stabilità chimica dei materiali legata alla liofilizzazione è un argomento vasto a causa dell'ampio numero di materiali che possono essere liofilizzati e alle tante reazioni chimiche che possono verificarsi, sia nel processo di liofilizzazione sia nella conservazione del materiale liofilizzato.
Una serie di queste reazioni chimiche è riportata qui di seguito. Possiamo dire che la nostra comprensione del sistema di funzionamento di queste reazioni è alquanto variabile. Per alcune, come ad esempio la sopravvivenza dei microorganismi, gli schemi generali di reazione non sono completamente compresi, mentre abbiamo una buona comprensione del meccanismo di reazioni di altri materiali.
I parametri di liofilizzazione o di conservazione che influenzano maggiormente la stabilità chimica sono il contenuto di umidità e la temperatura del materiale. È noto che la velocità di una reazione chimica aumenta con l'aumentare della temperatura e generalmente diminuisce con il diminuire del contenuto di umidità. (Alcune eccezioni alla “regola” del contenuto di umidità si osservano per l'ossidazione lipidica e per le reazioni di imbrunimento di Maillard).
Nella liofilizzazione abbiamo dei contenuti di umidità e temperatura molto variabili nel campione, poiché variano in base al tempo e alla posizione. Questo significa che la possibilità che si verifichino cambiamenti chimici all'interno del campione varia a seconda del tempo e della posizione. La nostra scelta delle condizioni di lavorazione deve pertanto prendere in considerazione i gradienti di temperatura e di umidità nel campione e il modo in cui mutano con l'avanzamento del processo di essiccazione.
Imbrunimento non-enzimatico: Vi sono una serie di meccanismi di reazione che sono raggruppati sotto la dicitura di imbrunimento non-enzimatico, poiché causano l'imbrunimento dei prodotti e non sono di natura enzimatica.
La reazione di Maillard (una reazione dei carbonili con le ammine) e la disidratazione dei carboidrati ad alta temperature (chiamata caramellizzazione) molto probabilmente potrebbero costituire un problema per la liofilizzazione.
La reazione di Maillard coinvolge generalmente la riduzione di carboidrati e amminoacidi (o proteine), entrambi presenti nei materiali biologici.
La reazione di caramellizzazione sembra verificarsi a temperature inferiori nella liofilizzazione rispetto a quanto avviene nei sistemi liquidi, forse a causa della rimozione dell'acqua prodotta nella reazione al momento della liofilizzazione.
Questo si nota soprattutto nei campioni che hanno valori di pH relativamente elevati o bassi (ovvero soluzioni altamente acide o basiche).
Oltre al colorito marrone che si sviluppa, queste reazioni provocano anche molte scomposizioni con un forte aroma e che possono servire come reagenti per altre reazioni. Inoltre, l'imbrunimento di Maillard che coinvolge le proteine può provocare una perdita dell'attività biologica.
Denaturazione delle proteine: Le proteine sono componenti importanti nel sistema biologico che agiscono come materiale strutturale e come catalizzatori di reazioni chimiche (enzimi). La capacità delle proteine di restare inalterate dipende da molti fattori, tra i quali la struttura geometrica.
La struttura della proteina viene stabilizzata dalla presenza di solventi (acqua liquida). Rimuovendo questo solvente si possono provocare dei cambiamenti strutturali.
Le catene laterali di amminoacidi divengono disponibili per le reazioni (sia con altre catene laterali sulla stessa molecola, sia con catene laterali di altre molecole) che modificano le caratteristiche della molecola della proteina. Quando l'acqua viene restituita al campione, queste molecole di proteine potrebbero essere incapaci di ritornare alla loro condizione originale.
I fattori che presentano un potenziale rischio di cambiamento della proteina sono i legami interni propri della proteina, la reattività della catena laterale e la temperatura con il contenuto di umidità nella liofilizzazione.
Distruzione del nutriente: Molti dei nutrienti negli alimenti (soprattutto la vitamina C) sono labili quando sottoposti al calore e in quanto tali la loro resistenza dipende dalle condizioni di temperatura nel processo di liofilizzazione. Il ruolo dell'umidità è molto meno noto, ma sembra che al diminuire del livello di umidità, l'alta sensibilità alla temperatura della reazione diminuisca allo stesso tempo.
Ossidazione lipidica: Dato che il reagente più importante, l'ossigeno, non è presente nella camera durante la liofilizzazione, questa reazione è la più importante durante la conservazione. Il materiale liofilizzato contenente grassi insaturi è particolarmente suscettibile poiché la struttura porosa del liofilizzato fornisce all'ossigeno un buon accesso alla superficie porosa interna del materiale. Ciò significa che i materiali che contengono lipidi devono essere imballati in materiali selezionati di alta qualità e a bassa trasmittanza, con chiusura a sottovuoto o gas inerte dello spazio libero dell'imballaggio, in modo da impedire il contatto tra grassi e ossigeno.
Vi sono anche indicazioni che i radicali liberi, che possono scatenare l'ossidazione dei lipidi, possono generarsi nel processo di liofilizzazione. Nello stato essiccato i radicali liberi sono alquanto stabili e pertanto la loro presenza impone addirittura requisiti maggiori per il raggiungimento degli obiettivi di imballaggio.
Rotture degli acidi nucleici: Vi sono state indicazioni nella letteratura scientifica che le mutazioni genetiche possono avvenire nelle culture microbiche liofilizzate. Si è proposto che i mutamenti genetici provengano dalle rotture degli acidi nucleici. A questo punto, è necessario notare che molte specie microbiche possono essere essiccate con successo senza subire mutamenti genetici e che non risultano pertanto essere una necessaria conseguenza della liofilizzazione. Al momento non si conosce a fondo la causa delle mutazioni genetiche o l'influenza dei parametri di liofilizzazione.
Riassunto della stabilità chimica: La velocità di reazione nei materiali liofilizzati dipende dai livelli di temperatura e di umidità nel campione, con una relazione interattiva tra questi parametri. Così, a seconda della sensibilità del materiale, potrebbe essere necessario ridurre la temperatura del campione a valori massimi particolari. In molti casi, il contenuto di umidità nel campione è legato al gradiente di temperatura nello strato essiccato e pertanto non può essere controllato in modo indipendente.
Supplemento C: Trasferimento di materia
Il trasferimento di materia (o trasporto di materia) è il movimento della materia da un punto ad un altro. Nella liofilizzazione ciò che interessa maggiormente è il movimento dell'acqua, specialmente dal campione ad un altro punto. La forza motrice per il trasporto della materia nella liofilizzazione è la differenza di pressione (in realtà, nella maggior parte dei casi in generale, è un concetto chiamato potenziale chimico che, nel nostro caso, può essere approssimato dalla pressione), mentre le resistenze sono una serie di attriti dovuti a pochi elementi.
Figura C 2 Sistema di base con distribuzione disomogenea delle molecole prima del trasferimento di materia.

Nella Figura C 1, ci sono due camere di volume uguali, sinistra (L) e destra (R) collegate da un tubo (T). Per separarle posizioniamo una valvola (V) nel condotto del tubo.
Se c'è una camera vuota, non c'è pressione nella camera poiché la pressione è una misura di un numero di molecole presenti un dato volume. Maggiore è il numero di molecole in un volume costante, maggiore è la pressione.
Anche la temperatura è importante; una temperatura più alta produce valori di pressione più elevati poiché ogni molecola ha più energia; tuttavia, in questa sede, lasciamo la temperatura costante.
In Figura C 1 disponiamo (a valvola chiusa) 100 unità di molecole d'acqua nella camera sinistra (NL=100) e 50 unità nella camera destra (NR= 50): ogni camera mostra la propria pressione, PL e PR. Cfr. Figura C 2.
Aprendo la valvola il sistema tende a bilanciarsi in modo che il numero di molecole è lo stesso in ogni camera (ovvero la pressione è uguale in ogni lato).
Questo bilanciamento viene raggiunto tramite il movimento fisico netto di 25 unità di molecole d'acqua dalla camera sinistra, attraverso il tubo e la valvola, alla camera destra (Figura C 3).
Così, si ottiene un trasferimento di materia grazie alla forza motrice della differenza di pressione.
Figura C 3 Sistema di base con distribuzione omogenea delle molecole dopo il trasferimento di materia.

Le resistenze al movimento di queste molecole d'acqua determinano la velocità di bilanciamento della pressione nelle due camere. Per resistenze possiamo intendere un numero di attriti e di ostacoli nel tubo e nella valvola, come ad esempio l'attrito che si verifica nel momento in cui una molecola d'acqua colpisce la parete del tubo, o altri ostacoli costituiti, per esempio, da una piastra con una piccola apertura nel tubo, o dalla presenza di molecole d'aria attraverso le quali le molecole d'acqua devono spostarsi.
Poiché le molecole d'acqua si muovono in direzione rettilinea, se il tubo non è dritto, è supponibile che le molecole d'acqua colpiscano le pareti più volte e quindi si muovano più lentamente attraverso il tubo.
Figura C 4 mostra un sistema in cui possiamo attenderci un trasferimento di materia più lento rispetto a quello del sistema nella Figura C 2, ma in tutti i casi la pressione è alla fine la stessa.
Fino ad ora abbiamo preso in esame un sistema semplice chiuso in cui è possibile raggiungere un equilibrio. Nella liofilizzazione è di maggiore interesse il caso dinamico in cui le molecole d'acqua vengono continuamente fornite nella camera L (chiamata fonte) e rimosse continuamente dalla camera R (chiamata scarico) così che i valori di NL e NR (e quindi PL e PR) restino invariati. In questo caso, possiamo ottenere un movimento continuo delle molecole d'acqua da L a R; la velocità di questo movimento dipende dalle resistenze.
Per considerare questa situazione dinamica, dobbiamo stabilire una fonte di molecole d'acqua e uno scarico di molecole d'acqua. Poiché il nostro fulcro d'interesse è il processo di liofilizzazione, baseremo la prossima analisi sulle condizioni legate alla liofilizzazione.
Se facciamo riferimento alla Figura A 1, possiamo vedere che il ghiaccio (acqua solida) a -20°C (punto J) esercita una pressione di circa 1 torr, mentre a -40°C esercita una pressione di circa 0,1 torr (punto K).
Pertanto, se torniamo alle nostre due camere della Figura C 1 e posizioniamo del ghiaccio nelle due camere, e successivamente regoliamo le temperature in modo tale che TL=-20°C e TR=-40°C, avremo il nostro requisito di una differenza di pressione dell'acqua tra le due camere (Figura C 5).
Il modo in cui possiamo controllare la temperature è affrontato nel Supplemento D. In queste condizioni, le molecole dell'acqua si spostano (proprio come nel nostro esempio precedente) dalla camera sinistra alla camera destra.
Se forniamo l'energia richiesta per convertire l'acqua solida in vapore acqueo (sublimazione) nella camera sinistra, appena le molecole di vapore lasciano la camera sinistra, se ne formano delle nuove dal ghiaccio.
Nella camera destra avviene l'azione opposta; l'energia viene sottratta e nuove molecole di vapore in arrivo si convertono da vapore a solido (condensazione). Così, l'effetto netto è una riduzione dell'acqua allo stato solido nella camera sinistra e un aumento corrispondente dell'acqua solida nella camera destra.
Questo è il trasferimento di materia di base che si verifica nella liofilizzazione.
Supplemento D: Trasferimento di calore
Lo spostamento di energia si verifica tramite un processo chiamato trasferimento di calore. Lo spostamento di energia è importante nella liofilizzazione poiché ogniqualvolta assistiamo ad un cambiamento di stato dell'acqua (da liquida a solida, da solida a vapore o da vapore a solida), è necessario sottrarre o fornire energia alle molecole d'acqua. Quindi, un parte essenziale del processo di liofilizzazione è il trasferimento di calore.
Vediamo tre modi di trasferimento di calore (cfr. Figura D 1). Notiamo che c'è una fonte di energia (qui illustrata con una fiamma – avremmo potuto usare un riscaldatore elettrico) sul fondo. Questa fonte di energia viene usata per aumentare l'energia delle molecole sulla superficie del fondo. Il contenuto di energia di un materiale può essere misurato dalla sua temperatura: maggiore è la temperatura, maggiore è il livello di energia.
Per i nostri esempi, supponiamo che l'energia della superficie inferiore sia la stessa come si nota dalla temperatura che è uguale (TL). Per trasferire questa energia dal punto L al punto U è necessaria una differenza di energia (ovvero la temperatura) tra i due punti; ovvero, la forza motrice per il trasferimento di calore è una differenza di temperatura.
La resistenza a questo trasferimento di energia dipende dal sistema fisico, e per semplicità, i tipi di trasferimento individuati sono di tre tipi: conduzione, convezione e irraggiamento, mostrati nella Figura D 1.
Conduzione è la modalità di trasferimento di energia nei solidi dove non vi è movimento fisico della materia.
La convezione è la modalità di trasferimento di energia nei liquidi, vapori e gas in cui l'energia viene tramite movimento fisico delle molecole in uno spazio. L'efficacia della convezione dipende in parte dal numero di molecole disponibili che agiscono come “portatori” di energia. Svuotando uno spazio (ad es creando un vuoto), non c'è convezione.
Il trasferimento di calore tra punti indipendenti può avvenire tramite un fenomeno chiamato irraggiamento. Poiché l'irraggiamento è relativamente indipendente dai gas (un bene per la liofilizzazione), si può ancora avere trasferimento di calore tra due punti indipendenti tramite questo sistema.
Consideriamo il caso statico in cui l'energia dalla superficie inferiore non può passare alla superficie superiore: in questo caso si avrà un trasferimento di energia fino a quando la superficie superiore raggiunge la stessa temperatura della superficie inferiore.
Pertanto, quando la forza motrice scompare, non vi è un ulteriore trasferimento di energia. La velocità alla quale ciò avviene dipende dalle resistenze al trasferimento di calore e possiamo in genere affermare che le resistenze aumentano nell'ordine la conduzione, la convezione e l'irraggiamento.
La situazione dinamica è di interesse più pratico e Figura D 2 mostra il processo ben noto del riscaldamento di un liquido fino all'ebollizione (evaporazione). Mentre possiamo descrivere le transizioni per l'acqua solida (ghiaccio) (scioglimento /sublimazione), poiché l'ebollizione è nota a tutti risulterebbe un esempio ovvio.
Figura D 2, mostra una pentola d'acqua su una piastra elettrica di cottura.
Se il contatto fisico tra la pentola e la piastra è buono, avremo un trasferimento di calore per conduzione; se il contatto non è buono, avremo probabilmente una combinazione di conduzione e di convezione.
Con l'accensione della piastra elettrica si converte l'energia elettrica in energia di riscaldamento. Questo fa aumentare il livello di energia della piastra di riscaldamento, osservato come un cambiamento di temperatura. Ora abbiamo stabilito un gradiente di temperatura tra la piastra di riscaldamento e la pentola d'acqua e pertanto avremo una forza motrice per il trasferimento di energia termica.
L'energia trasferita alle molecole d'acqua nella pentola aumenta la loro energia e si osserva così un aumento nella temperatura dell'acqua.
La velocità alla quale la temperatura aumenta dipende in parte dalla grandezza delle resistenze al trasferimento di calore esistente.
Se la nostra pentola è aperta in modo tale che la pressione esterna è 1013 mbar (1 atm), possiamo vedere, dalla Figura A 1, che quando l'acqua raggiunge una temperatura di +100°C (ovvero le molecole d'acqua raggiungono il livello di energia corrispondente), un ulteriore trasferimento di energia alle molecole d'acqua causerebbe un cambiamento dello stato da liquido a vapore, che chiamiamo ebollizione (ovvero attraversiamo la linea al punto E).
Per raggiungere questo cambiamento di stato è necessario un trasferimento di energia alle molecole d'acqua. Nel processo di ebollizione serve più energia per dare luogo al cambio di stato nelle molecole dell'acqua di quanta ne serva per riscaldarle fino alla temperatura di ebollizione.
Ogni volta che attraversiamo una linea di stato nella Figura A 1, necessitiamo di trasmissione o di rimozione di energia. Spostandoci da sinistra a destra nella Figura A 1 si necessita di trasmissione di energia, mentre se ci si sposta da destra verso sinistra si necessita di una rimozione di energia. Analogamente, nella Figura A 2 o Figura A 3, spostandosi in alto o in basso rispettivamente si ha bisogno di trasmissione o di rimozione di energia.
Possiamo tornare ora alla Figura C 5, in cui il ghiaccio è stato trasportato dalla camera sinistra alla camera destra. Abbiamo presupposto che TL si trovava a -20°C, mentre TR era a -40°C per il trasferimento di energia (ovvero trasferimento termico).
Per raggiungere questo obiettivo, possiamo immaginare un riscaldatore elettrico nella camera sinistra per fornire il calore necessario a generare molecole di vapore acqueo dal ghiaccio (sublimazione), mentre per la camera destra possiamo usare la serpentina di un congelatore per sottrarre calore in modo tale che queste molecole d'acqua si condensino fino a diventare ghiaccio (condensazione) ed essere quindi rimosse dallo spazio del vapore.
Nei Supplementi C e D abbiamo sviluppato la base per il processo di liofilizzazione - una combinazione di trasferimento di materia e di trasferimento di calore.
In questo fascicolo abbiamo iniziato la nostra analisi sulla liofilizzazione a un livello molto basilare e successivamente abbiamo sviluppato l'argomento attraverso analisi più dettagliate delle proprietà dei materiali e delle fasi del processo di liofilizzazione. In questa sede, non è chiaramente possibile trattare tutti gli argomenti legati alla liofilizzazione (come ad esempio i calcoli ingegneristici, o l'uso di additivi nelle colture microbiche di liofilizzazione, per citarne solo due impossibili da includere in questa sede). Pertanto, qui di seguito abbiamo riportato un elenco di riferimenti generali sulla liofilizzazione utili come compendio alle informazioni presentate in questo fascicolo.
Si dovrebbe forse far presente che molta della letteratura menzionata qui di seguito si riferisce alla liofilizzazione negli alimenti. Questo orientamento è nato dal fatto che la conservazione del cibo è stata originariamente considerata l'applicazione principale della liofilizzazione. L'interesse per la liofilizzazione in seguito si è allargato anche alla conservazione di materiali attivi biologicamente.
In ogni caso, è importante sottolineare che molti dei riferimenti elencati che includono alimenti nei propri titoli trattano in modo eccellente il processo di liofilizzazione in genere, e pertanto saranno di interesse per gli utenti con un orientamento maggiormente biologico. Inoltre, molti di questi riferimenti contengono anche sezioni sulla liofilizzazione di preparati biologici.
Poiché si tratta di un elenco limitato, non sono stati presentati articoli di ricerca individuali.
I riferimenti agli articoli di ricerca possono essere reperiti nei riferimenti dei libri di qui seguito elencati. Oltre a questi testi, altre ottime fonti per reperire articoli di ricerca in merito alla liofilizzazione sono il science citation index e chemical abstracts (o i database associati): ricercare nei titoli “liofilizzazione, liofilizzato, freeze drying, o freeze-dried".
Harper, J. C. and Tappel, A. L. 1957.
Freeze Drying of Food Products Advances in Food Research, Vol. 7
Academic Press
Rey, L. 1960.
Traité de Lyophilisation
Herman, Paris (French and English Articles)
Fisher, F. J. 1962.
Freeze Drying of Foods
National Academy of Science - National Research Council
Washington, D. C.
Rey, L. 1964.
Aspects théoriques et industriels de la lyophilisation (Research and Developments in Freeze Drying)
Herman, Paris (French and English Articles)
Burke, R. F. and Decareau, R. V. 1964.
Freeze Dehydration of Foods
Advances in Food Research, Vol. 13
Academic Press
Rey, L. 1966.
Advances in Freeze Drying (Lyophilisation. Recherches et Applications Nouvelles)
Herman, Paris (French and English Articles)
King, C. J. 1971.
Freeze Drying of Foods
CRC Press
Goldblith, S. A., Rey, L., and Rothmayr, W. W. 1975.
Freeze Drying and Advanced Food Technology
Academic Press
Cabasso, V. J. and Regamey, R. H. 1977.
Freeze Drying of Biological Products
Developments in Biological Standardization, Vol. 36
S. Karger
Mellor, J. D. 1978.
Fundamentals of Freeze Drying
Academic Press
Oltre ai libri sopra indicati, vi sono Atti di Convegni e Congressi dell'International Institute of Refrigeration (soprattutto Commission 10 (ora C1)-Freeze Drying, Cryobiology, Medical Applications). Tali documenti sono generalmente definiti bollettini, Proceedings of Annex of the IIR.
1969 - Losanna -Thermodynamic Aspects of Freeze Drying
1969 - Parigi - Surface Reactions in Freeze Dried Systems
1971 - Washington - Progress in Refrigeration Science and Technology (Freeze Drying)
1973 - Sapporo - Freeze Drying of Biological Materials
1974 - Bressanone - Heat and Mass Transport during Freeze Drying of Food Stuffs
1975 - Mosca - Freeze Drying
1979 – Venezia - Freeze Drying, Cryobiology, Medical Applications